Les complications cardiovasculaires apparaissent rapidement comme une menace majeure dans la maladie à coronavirus 2019 (COVID-19), en plus des maladies respiratoires. Cependant, les mécanismes sous-jacents à l’effet disproportionné de l’infection par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) chez les patients présentant des comorbidités cardiovasculaires restent incomplètement compris. 2
Le SRAS-CoV-2 infecte l’hôte à l’aide du récepteur de l’ enzyme de conversion de l’angiotensine 2 (ACE2), qui est exprimé dans plusieurs organes, notamment les poumons, le cœur, les reins et l’intestin. Les récepteurs ACE2 sont également exprimés par les cellules endothéliales.
On ne sait pas actuellement si les troubles vasculaires du COVID-19 sont dus à l’implication des cellules endothéliales par le virus. Il est intéressant de noter que le SRAS-CoV-2 peut infecter directement les organoïdes des vaisseaux sanguins humains conçus in vitro.4
Nous démontrons ici l’implication des cellules endothéliales dans les lits vasculaires de différents organes chez une série de patients atteints de COVID-19.
Le patient 1 était un homme de 71 ans, greffé d’un rein, souffrant d’une maladie coronarienne et d’hypertension. L’état du patient s’est détérioré après le diagnostic de COVID-19 et il a nécessité une ventilation mécanique. Une défaillance multiviscérale s’est produite et le patient est décédé au huitième jour.
L’analyse post mortem du rein transplanté par microscopie électronique a révélé des structures d’inclusion virales dans les cellules endothéliales (Figure A, B). Dans les analyses histologiques, nous avons constaté une accumulation de cellules inflammatoires associées à l’endothélium, ainsi que de corps apoptotiques, dans le cœur, l’intestin grêle (figure C) et le poumon (figure D). Une accumulation de cellules mononucléées a été constatée dans les poumons et la plupart des petits vaisseaux pulmonaires semblaient congestionnés.
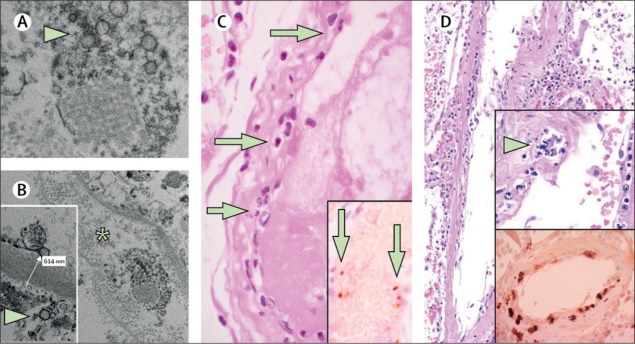
(A, B) La microscopie électronique du tissu rénal montre des corps d’inclusion virale dans un espace péritubulaire et des particules virales dans les cellules endothéliales des anses capillaires glomérulaires. Des agrégats de particules virales (flèche) apparaissent avec une surface circulaire dense et un centre clair. L’astérisque dans le panneau B marque l’espace péritubulaire compatible avec le capillaire contenant des particules virales. L’encart du panneau B montre la membrane basale glomérulaire avec des cellules endothéliales et une particule virale (flèche ; environ 150 nm de diamètre). (C) Échantillon de résection de l’intestin grêle du patient 3, coloré à l’hématoxyline et à l’éosine. Les flèches indiquent les infiltrats de cellules mononucléées dominantes dans l’intima le long de la lumière de nombreux vaisseaux. L’encadré du panneau C montre la coloration immunohistochimique de la caspase 3 dans des échantillons d’intestin grêle provenant de la coupe en série du tissu décrite dans le panneau D. Les modèles de coloration étaient cohérents avec l’apoptose des cellules endothéliales et des cellules mononucléées observées dans les coupes colorées à l’hématoxyline-éosine. indiquant que l’apoptose est induite dans une proportion substantielle de ces cellules. (D) Un échantillon de poumon post mortem coloré à l’hématoxyline et à l’éosine présentait des septa pulmonaires épaissis, y compris un gros vaisseau artériel avec une infiltration mononucléaire et neutrophile (flèche dans l’encadré supérieur). L’encadré inférieur montre la coloration immunohistochimique de la caspase 3 dans le même échantillon de poumon ; Ces modèles de coloration étaient cohérents avec l’apoptose des cellules endothéliales et des cellules mononucléées observée dans les coupes colorées à l’hématoxyline-éosine. COVID-19 = maladie à coronavirus 2019.
La patiente 2 était une femme de 58 ans souffrant de diabète, d’hypertension artérielle et d’obésité. Elle a développé une insuffisance respiratoire progressive due au COVID-19, puis une défaillance multiviscérale et a nécessité une thérapie de remplacement rénal.
Au jour 16, l’ischémie mésentérique a conduit à l’ablation de l’intestin grêle nécrotique. Une insuffisance circulatoire s’est produite dans le cadre d’une insuffisance cardiaque droite secondaire à un infarctus du myocarde avec sus-décalage du segment ST, et un arrêt cardiaque a entraîné la mort.
L’histologie post-mortem a révélé une endothéliite lymphocytaire dans les poumons, le cœur, les reins et le foie, ainsi qu’une nécrose des cellules hépatiques. Nous avons trouvé des signes histologiques d’infarctus du myocarde mais aucun signe de myocardite lymphocytaire. L’histologie de l’intestin grêle montrait une endothéliite (endothélialité) des vaisseaux sous-muqueux.
Le patient 3 était un homme de 69 ans souffrant d’hypertension qui a développé une insuffisance respiratoire à la suite du COVID-19 et qui a nécessité une ventilation mécanique. L’échocardiographie a montré une fraction d’éjection ventriculaire gauche réduite. Un collapsus circulatoire s’est produit avec une ischémie mésentérique et une résection de l’intestin grêle a été réalisée, mais le patient a survécu. L’histologie de la résection de l’intestin grêle a révélé une endothéliite importante des vaisseaux sous-muqueux et des corps apoptotiques (Figure C).
Nous avons trouvé des preuves d’une infection virale directe de la cellule endothéliale et d’une inflammation endothéliale diffuse. Bien que le virus utilise le récepteur ACE2 exprimé par les pneumocytes de la muqueuse épithéliale alvéolaire pour infecter l’hôte, provoquant ainsi des lésions pulmonaires, le récepteur ACE2 est également largement exprimé sur les cellules endothéliales, qui traversent plusieurs organes.3
Le recrutement de cellules immunitaires, soit par infection virale directe de l’endothélium, soit par l’intermédiaire du système immunitaire, peut conduire à un dysfonctionnement endothélial généralisé associé à l’apoptose (Figure D). L’ endothélium vasculaire est un organe paracrine, endocrinien et autocrine actif, essentiel à la régulation du tonus vasculaire et au maintien de l’homéostasie vasculaire.
Le dysfonctionnement endothélial est un déterminant majeur du dysfonctionnement microvasculaire en déplaçant l’équilibre vasculaire vers une vasoconstriction accrue avec une ischémie organique ultérieure, une inflammation accompagnée d’un œdème tissulaire associé et un état procoagulant .
Nos résultats montrent la présence d’éléments viraux dans les cellules endothéliales et une accumulation de cellules inflammatoires, avec des preuves de mort cellulaire endothéliale et inflammatoire. Ces résultats suggèrent que l’infection par le SRAS-CoV-2 facilite l’induction de l’endothélite dans divers organes en conséquence directe de l’implication virale (comme observé avec la présence de corps viraux) et de la réponse inflammatoire de l’hôte.
En outre, l’induction de l’apoptose et de la pyroptose pourrait jouer un rôle important dans les lésions des cellules endothéliales chez les patients atteints de COVID-19. L’endothéliite au COVID-19 pourrait expliquer la fonction microcirculatoire systémique dans différents lits vasculaires et ses séquelles cliniques chez les patients atteints du COVID-19.
Cette hypothèse justifie les thérapies visant à stabiliser l’endothélium tout en abordant la réplication virale, en particulier avec des médicaments anti-inflammatoires anti-cytokines, des inhibiteurs de l’ECA et des statines 7, 8, 9, 10, 11.
Cette stratégie pourrait être particulièrement pertinente pour les patients vulnérables présentant un dysfonctionnement endothélial préexistant , associé au sexe masculin, au tabagisme, à l’hypertension, au diabète, à l’obésité et aux maladies cardiovasculaires établies, qui sont tous associés à des conséquences indésirables dans le cadre de la COVID-19. 19.
Déclaration de conflits d’intérêts des auteurs
ZV et AJF ont contribué à parts égales en tant que premiers auteurs, et RAS, FR et HM ont contribué à parts égales en tant que derniers auteurs. L’AJF rapporte des taux d’Alnylam, Amgen, AstraZeneca, Fresenius, Imedos Systems, Novartis, Pfizer, Roche, Vifor et Zoll, sans rapport avec cette correspondance. MRM fait état de relations de consultation avec Abbott, Medtronic, Janssen, Mesoblast, Portola, Bayer, NupulseCV, FineHeart, Leviticus, Baim Institute for Clinical Research, Riovant et Triple Gene, sans rapport avec cette correspondance. FR a été rémunéré pour le temps passé en tant que membre de comités pour des essais cliniques, des conseils consultatifs, d’autres formes de conseil et des discours ou présentations. Ces paiements ont été versés directement à l’Université de Zurich et aucun paiement personnel n’a été reçu en relation avec ces essais ou d’autres activités. Tous les autres auteurs ne déclarent aucun intérêt concurrent.
















