L’essai STEP-HFpEF a été présenté lors d’une session Hot Line lors du congrès ESC 2023
Les médicaments amaigrissants profitent aux patients souffrant d’insuffisance cardiaque et d’obésité
Le sémaglutide améliore les symptômes et la fonction physique liés à l’insuffisance cardiaque et entraîne une perte de poids plus importante que le placebo chez les patients souffrant d’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF) et d’obésité, selon une étude de pointe présentée lors d’une session Hot Line au congrès ESC 2023.

Environ la moitié des patients atteints d’insuffisance cardiaque dans la communauté souffrent d’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF). La majorité des patients atteints d’ICFpEF sont en surpoids ou obèses , et de plus en plus de preuves suggèrent que l’obésité et l’excès d’adiposité ne sont pas de simples comorbidités, mais peuvent jouer un rôle essentiel dans le développement et la progression de l’ICFpEF. Les patients atteints d’HFpEF liés à l’obésité présentent un fardeau particulièrement élevé de symptômes débilitants (essoufflement, intolérance à l’effort, gonflement/œdème) et de limitations physiques, qui, ensemble, entraînent une mauvaise qualité de vie. Il existe peu d’options de traitement disponibles et il n’existe aucun traitement approuvé ciblant spécifiquement le phénotype d’obésité de l’HFpEF.
Le sémaglutide est un puissant agoniste des récepteurs du peptide 1 de type glucagon qui, il a déjà été démontré, entraîne une perte de poids substantielle chez les personnes en surpoids et obèses . L’essai STEP-HFpEF a testé l’hypothèse selon laquelle le traitement au sémaglutide peut améliorer de manière significative les symptômes, les limitations physiques et la fonction d’exercice, en plus de la perte de poids, chez les patients atteints d’HFpEF et d’obésité.
STEP-HFpEF était un essai randomisé, en double aveugle, contrôlé par placebo, mené dans 96 centres répartis dans 13 pays d’Asie, d’Europe, d’Amérique du Nord et d’Amérique du Sud. L’essai a inclus des patients présentant une HFpEF (fraction d’éjection ventriculaire gauche ≥ 45 %), un indice de masse corporelle (IMC) ≥ 30 kg/m2, des symptômes d’insuffisance cardiaque et des limitations fonctionnelles (classe fonctionnelle II-IV de la New York Heart Association et cardiomyopathie de Kansas City). Score du résumé clinique du questionnaire [KCCQ-CSS] <90 points).
Les participants ont été répartis au hasard selon un rapport de 1:1 pour recevoir 2,4 mg de sémaglutide sous-cutané une fois par semaine ou un placebo pendant 52 semaines .
L’essai avait deux critères d’évaluation principaux : changement entre le départ et la semaine 52 en 1) KCCQ-CSS, une mesure de référence des symptômes et des limitations physiques liés à l’insuffisance cardiaque ; et 2) le poids corporel. Les critères d’évaluation secondaires de confirmation comprenaient la modification de la distance de marche de 6 minutes (6MWD, une mesure validée de la fonction d’exercice) ; un critère d’évaluation composite hiérarchique de décès, d’événements d’insuffisance cardiaque et de changement dans KCCQ-CSS et 6MWD ; et modification de la protéine C-réactive (CRP, une mesure de l’inflammation).
L’essai a inclus 529 patients . L’âge médian était de 69 ans et 56,1 % étaient des femmes. Le poids corporel médian et l’IMC au départ étaient respectivement de 105,1 kg et 37,0 kg/m2. Au départ, les patients présentaient un degré important de symptômes liés à l’insuffisance cardiaque, de limitations physiques et d’une mauvaise tolérance à l’exercice : 66,2 % étaient de classe NYHA II et 33,8 % de classe NYHA III-IV. la NYHA; la médiane du KCCQ-CSS était de 58,9 points ; et la médiane 6MWD était de 320 mètres.
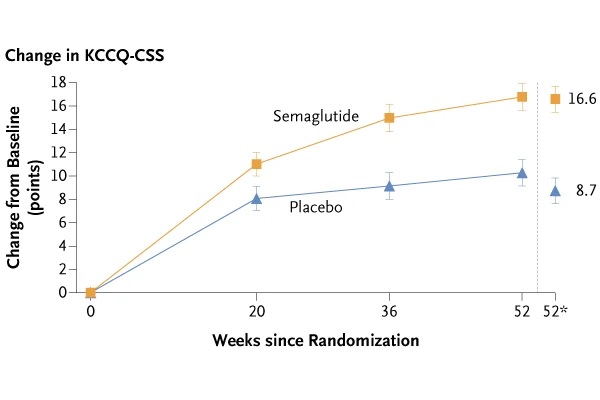
L’essai a satisfait à la fois aux critères d’évaluation principaux et à tous les critères d’évaluation secondaires de confirmation. La variation moyenne du KCCQ-CSS entre l’inclusion et la semaine 52 était de 16,6 points avec le sémaglutide versus 8,7 points avec le placebo (différence estimée entre les traitements [ETD] : 7,8 points, intervalle de confiance [IC] 95 % : 4,8 à 10,9 ; p < 0,001). La variation moyenne du poids corporel entre l’inclusion et la semaine 52 était de -13,3 % avec le sémaglutide versus -2,6 % avec le placebo (ETD : -10,7 %, IC à 95 % : -11,9 % à - 9,4 % ; p < 0,001).
Concernant les critères secondaires, la variation moyenne de la marche en 6 minutes (6MWD) était de 21,5 mètres pour le sémaglutide versus 1,2 mètre pour le placebo (ETD : 20,3 mètres, IC 95% : 8,6 à 32,1 ; p<0,001). Pour le critère d’évaluation composite hiérarchique, le sémaglutide a produit plus de victoires que le placebo (taux de victoire 1,72, IC à 95 % 1,37 à 2,15, p < 0,001). La variation moyenne de la CRP était respectivement de -43,5 % et -7,3 % avec le sémaglutide et le placebo (rapport de traitement estimé à 0,61, IC à 95 % entre 0,51 et 0,72, p < 0,001).
En termes de critères d’évaluation exploratoires, la variation du NTproBNP à 52 semaines était de -20,9 % et de -5,3 % pour le sémaglutide par rapport au placebo (rapport de traitement estimé à 0,84, IC à 95 % de 0,71 à 0,98). Un patient du groupe sémaglutide et 12 du groupe placebo ont présenté un événement reconnu d’hospitalisation pour insuffisance cardiaque ou de visite urgente (rapport de risque 0,08, IC à 95 % 0,00 à 0,42).
Des événements indésirables graves ont été rapportés chez 35 (13,3 %) et 71 (26,7 %) participants recevant le sémaglutide et le placebo, respectivement (p < 0,001).
Le chercheur principal, le Dr Mikhail Kosiborod du Saint Luke’s Mid America Heart Institute, à Kansas City, aux États-Unis, a déclaré : « Chez les patients atteints d’HFpEF et d’obésité, le traitement avec 2,4 mg de sémaglutide a produit de grandes améliorations des symptômes, des limitations physiques et de la fonction d’exercice, réduisant l’inflammation. et a entraîné une perte de poids plus importante et moins d’événements indésirables graves par rapport au placebo. À notre connaissance, il s’agit du premier essai d’un agent pharmacologique ciblant spécifiquement l’obésité comme stratégie de traitement de l’HFpEF, et l’ampleur du bénéfice que nous avons observé est la plus importante observée avec. tout agent dans l’HFpEF Cela est susceptible d’avoir un impact significatif sur la pratique clinique, d’autant plus qu’il y a un manque de thérapies efficaces dans ce groupe de patients vulnérables.

Conclusions Chez les patients souffrant d’insuffisance cardiaque avec fraction d’éjection préservée et d’obésité, le traitement par sémaglutide (2,4 mg) a entraîné une plus grande réduction des symptômes et des limitations physiques, de plus grandes améliorations de la fonction d’exercice et une plus grande perte de poids que le placebo. |
: Référence : Sémaglutide chez les patients souffrant d’insuffisance cardiaque avec fraction d’éjection préservée et d’obésité . Mikhail N. Kosiborod, MD, Steen Z. Abildstrøm, Ph.D., Barry A. Borlaug, MD, Javed Butler, MD, et al. NEJM DOI : 10.1056/NEJMoa2306963
(Financé par Novo Nordisk ; numéro STEP-HFpEF ClinicalTrials.gov, NCT04788511. s’ouvre dans un nouvel onglet.)
















