Résumé L’altération de la fonction olfactive est un symptôme courant du COVID-19, mais son étiologie est inconnue. Une question clé est de savoir si le SRAS-CoV-2 (CoV-2), l’agent causal du COVID-19, affecte l’odorat directement, en infectant les neurones sensoriels olfactifs ou leurs cibles dans le bulbe olfactif, ou indirectement, en perturbant les cellules de soutien. Ici, nous identifions les types de cellules de l’épithélium olfactif et du bulbe olfactif qui expriment les molécules d’entrée cellulaire du SRAS-CoV-2. Un séquençage massif a démontré que la muqueuse olfactive de souris, de primates non humains et humaine exprime deux gènes clés impliqués dans l’entrée du CoV-2, ACE2 et TMPRSS2. Cependant, le séquençage unicellulaire a révélé que l’ACE2 est exprimé dans les cellules de soutien, les cellules souches et les cellules périvasculaires, plutôt que dans les neurones. L’immunomarquage a confirmé ces résultats et a révélé une expression généralisée de la protéine ACE2 dans les cellules épithéliales olfactives situées dorsalement et dans les péricytes du bulbe olfactif chez la souris. Ces résultats suggèrent que l’infection par le CoV-2 de types de cellules non neuronales entraîne une anosmie et des altérations associées de la perception des odeurs chez les patients atteints de COVID-19. |
Comment le COVID-19 provoque la perte de l’odorat Harvard Medical School. Par Kevin Jiang
La perte temporaire de l’odorat, ou anosmie, est le principal symptôme neurologique et l’un des indicateurs les plus précoces et les plus fréquemment signalés du COVID-19. Des études suggèrent qu’il s’agit d’un meilleur prédicteur de maladie que d’autres symptômes bien connus tels que la fièvre et la toux, mais les mécanismes sous-jacents de la perte d’odorat chez les patients atteints de COVID-19 restent flous.
Aujourd’hui, une équipe internationale de chercheurs dirigée par des neuroscientifiques de la Harvard Medical School a identifié les types de cellules olfactives de la cavité nasale supérieure les plus vulnérables à l’infection par le SRAS-CoV-2, le virus responsable du COVID-19.
Étonnamment, les neurones sensoriels qui détectent et transmettent l’odorat au cerveau ne font pas partie des types de cellules vulnérables.
Dans un rapport publié dans Science Advances, l’équipe de recherche a découvert que les neurones sensoriels olfactifs n’expriment pas le gène qui code pour la protéine réceptrice ACE2, que le SRAS-CoV-2 utilise pour pénétrer dans les cellules humaines. Au lieu de cela, l’ACE2 est exprimé dans les cellules qui fournissent un soutien métabolique et structurel aux neurones sensoriels olfactifs, ainsi qu’à certaines populations de vaisseaux sanguins et de cellules souches.
Les résultats suggèrent que l’infection de types de cellules non neuronales pourrait être responsable de l’anosmie chez les patients atteints de COVID-19 et contribuer à éclairer les efforts visant à mieux comprendre la progression de la maladie.
"Nos résultats indiquent que le nouveau coronavirus modifie l’odorat des patients non pas en infectant directement les neurones, mais en affectant la fonction des cellules de soutien", a déclaré l’auteur principal de l’étude, Sandeep Robert Datta, professeur agrégé de neurobiologie. à l’Institut Blavatnik du HMS.
Cela implique que, dans la plupart des cas, il est peu probable que l’infection par le SRAS-CoV-2 endommage de manière permanente les circuits neuronaux olfactifs et provoque une anosmie persistante, a ajouté Datta, une maladie associée à divers problèmes de santé mentale. et sociales, en particulier la dépression et l’anxiété.
"Je pense que c’est une bonne nouvelle, car une fois l’infection guérie, les neurones olfactifs ne semblent pas avoir besoin d’être remplacés ou reconstruits à partir de zéro", a-t-il déclaré. "Mais nous avons besoin de plus de données et d’une meilleure compréhension des mécanismes sous-jacents pour confirmer cette conclusion."
La plupart des patients atteints du COVID-19 souffrent d’un certain niveau d’anosmie, le plus souvent temporaire. Les analyses des dossiers médicaux électroniques indiquent que les patients atteints de COVID-19 sont 27 fois plus susceptibles d’avoir une perte d’odorat, mais seulement 2,2 à 2,6 fois plus susceptibles d’avoir de la fièvre, de la toux ou un essoufflement, par rapport aux patients sans COVID-19.
Certaines études ont laissé entendre que l’anosmie du COVID-19 diffère de l’anosmie causée par d’autres infections virales, notamment d’autres coronavirus.
Par exemple, les patients atteints du COVID-19 récupèrent généralement leur odorat au fil des semaines, beaucoup plus rapidement que les mois qu’il faut pour se remettre d’une anosmie causée par un sous-ensemble d’infections virales connues pour endommager directement les neurones sensoriels olfactifs. .
De plus, de nombreux virus provoquent une perte temporaire de l’odorat en déclenchant des problèmes des voies respiratoires supérieures, comme la congestion nasale. Certains patients atteints du COVID-19 souffrent cependant d’anosmie sans obstruction nasale .
Identifier la vulnérabilité
Dans la présente étude, Datta et ses collègues ont cherché à mieux comprendre comment le sens de l’odorat est modifié chez les patients COVID-19 en identifiant les types de cellules les plus vulnérables à l’infection par le SRAS-CoV-2.
Ils ont commencé par analyser les ensembles de données de séquençage unicellulaire existants qui, au total, cataloguaient les gènes exprimés par des centaines de milliers de cellules individuelles dans les cavités nasales supérieures des humains, des souris et des primates non humains.
Animation Ace2 : Rick Groleau
L’équipe s’est concentrée sur le gène ACE2 , largement présent dans les cellules des voies respiratoires humaines, qui code pour la principale protéine réceptrice que le SRAS-CoV-2 cible pour pénétrer dans les cellules humaines. Ils ont également examiné un autre gène, TMPRSS2 , qui code pour une enzyme considérée comme importante pour l’entrée du SRAS-CoV-2 dans la cellule.
Les analyses ont révélé qu’ACE2 et TMPRSS2 sont exprimés par des cellules de l’épithélium olfactif, un tissu spécialisé situé dans le toit de la cavité nasale, responsable de la détection des odeurs et qui abrite les neurones sensoriels olfactifs et diverses cellules de soutien.
Cependant, aucun des gènes n’a été exprimé par les neurones sensoriels olfactifs. Au lieu de cela, ces neurones exprimaient des gènes associés à la capacité d’autres coronavirus à pénétrer dans les cellules.
Les chercheurs ont découvert que deux types de cellules spécifiques de l’épithélium olfactif exprimaient l’ACE2 à des niveaux similaires à ceux observés dans les cellules des voies respiratoires inférieures, les cibles les plus courantes du SRAS-CoV-2, ce qui suggère une vulnérabilité à l’infection.
Il s’agit notamment de cellules sustainaculaires, qui s’enroulent autour des neurones sensoriels et sont censées fournir un soutien structurel et métabolique , et de cellules basales, qui agissent comme des cellules souches qui régénèrent l’épithélium olfactif après un dommage. La présence de protéines codées par les deux gènes dans ces cellules a été confirmée par immunomarquage.
Dans des expériences supplémentaires, les chercheurs ont découvert que les cellules souches épithéliales olfactives exprimaient la protéine ACE2 à des niveaux plus élevés après des dommages induits artificiellement, par rapport aux cellules souches au repos. Cela peut suggérer une vulnérabilité supplémentaire au SRAS-CoV-2, mais il n’est pas clair si cela est important pour l’évolution clinique de l’anosmie chez les patients atteints de COVID-19, ont déclaré les auteurs.
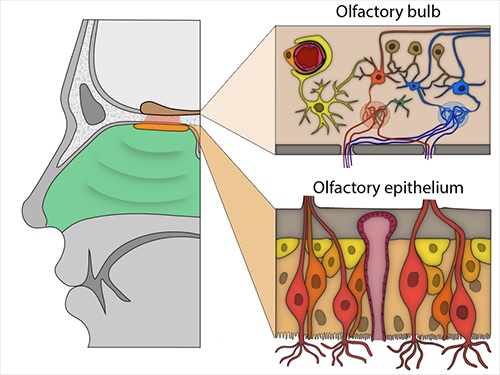
Bulbe olfactif et épithélium. Cellules importantes : En haut à droite : Un péricyte (orange clair) s’enroule autour d’un vaisseau sanguin (rouge). En bas à droite : neurones sensoriels olfactifs (rouge clair, orange) entourés de cellules sustainaculaires (bronze) et de cellules basales (jaune clair et orange). Image : Brann et. al., 2020.
Datta et ses collègues ont également analysé l’expression des gènes dans près de 50 000 cellules individuelles du bulbe olfactif de la souris, la structure du cerveau antérieur qui reçoit les signaux des neurones sensoriels olfactifs et est responsable du traitement initial des odeurs.
Les neurones du bulbe olfactif n’exprimaient pas ACE2.
Le gène et la protéine associée étaient présents uniquement dans les cellules des vaisseaux sanguins, en particulier les péricytes, impliqués dans la régulation de la pression artérielle, le maintien de la barrière hémato-encéphalique et les réponses inflammatoires. Aucun type de cellule du bulbe olfactif n’exprimait le gène TMPRSS2.
Indice de perte d’odorat
Ensemble, ces données suggèrent que l’anosmie liée au COVID-19 pourrait résulter d’une perte temporaire de la fonction cellulaire de soutien dans l’épithélium olfactif, ce qui provoque indirectement des modifications dans les neurones sensoriels olfactifs, ont déclaré les auteurs.
"Cependant, nous ne comprenons toujours pas vraiment quels sont ces changements", a déclaré Datta. "Les cellules sustaculaires ont été largement ignorées, et il semble que nous devons y prêter attention, de la même manière que nous apprécions de plus en plus le rôle critique que jouent les cellules gliales dans le cerveau."
Les résultats offrent également des indices intéressants sur les problèmes neurologiques associés au COVID-19. Les observations concordent avec l’hypothèse selon laquelle le SRAS-CoV-2 n’infecte pas directement les neurones, mais pourrait plutôt interférer avec le fonctionnement cérébral en affectant les cellules vasculaires du système nerveux, ont indiqué les auteurs. Cela nécessite davantage de recherches pour être vérifié, ont-ils ajouté.
Les résultats de l’étude contribuent désormais à accélérer les efforts visant à mieux comprendre la perte d’odorat chez les patients atteints de COVID-19, ce qui pourrait conduire à des traitements contre l’anosmie et au développement de meilleurs diagnostics basés sur l’odorat pour la maladie.
"L’anosmie semble être un phénomène curieux, mais elle peut être dévastatrice pour la petite fraction des personnes chez qui elle persiste", a déclaré Datta. "Cela peut avoir de graves conséquences psychologiques et pourrait constituer un problème de santé publique majeur si nous avons une population croissante avec une perte permanente de l’odorat."
L’équipe espère également que les données pourront aider à ouvrir la voie à des questions sur la progression de la maladie, par exemple si le nez agit comme un réservoir pour le SRAS-CoV-2 . De tels efforts nécessiteront des études dans des installations permettant des expériences avec des coronavirus vivants et l’analyse de données d’autopsie humaine, ont indiqué les auteurs, qui sont encore difficiles à obtenir. Cependant, l’esprit de collaboration qui caractérise la recherche scientifique à l’ère de la pandémie exige de l’optimisme.
"Nous avons commencé ce travail parce que mon laboratoire disposait de quelques ensembles de données prêts à être analysés lorsque la pandémie a frappé, et nous avons publié une première prépublication", a déclaré Datta. « Ce qui s’est passé ensuite était incroyable : des chercheurs du monde entier ont proposé de partager et de fusionner leurs données avec nous dans une sorte de consortium mondial de fortune. "C’était une véritable réussite collaborative."
Les premiers co-auteurs de l’étude sont David Brann, Tatsuya Tsukahara et Caleb Weinreb. Parmi les autres auteurs figurent Marcela Lipovsek, Koen Van den Berge, Boying Gong, Rebecca Chance, Iain Macaulay, Hsin-jung Chou, Russell Fletcher, Diya Das, Kelly Street, Hector Roux de Bezieux, Yoon-Gi Choi, Davide Risso, Sandrine Dudoit, Elizabeth Purdom, Jonathan Mill, Ralph Abi Hachem, Hiroaki Matsunami, Darren Logan, Bradley Goldstein, Matthew Grubb et John Ngai.
L’étude a été financée par des subventions des National Institutes of Health (subventions RO11DC016222 et U19 NS112953) et de la Collaboration Simons sur le cerveau mondial. Des informations supplémentaires sur le financement peuvent être trouvées dans le texte intégral du document. DOI : 10.1126/sciadv.abc1564
















