Résumé Les éditeurs de bases de cytosine et d’adénine (ABE) peuvent corriger les mutations ponctuelles de manière prévisible et indépendante des cassures de l’ADN double brin induites par Cas9 (qui provoquent une formation substantielle d’indel) et de la réparation dirigée par l’homologie (ce qui conduit généralement à une faible efficacité d’édition). Nous montrons ici, chez la souris adulte, qu’une injection sous-rétinienne d’un virus adéno-associé exprimant un ABE et un ARN guide unique ciblant une mutation faux-sens de novo dans le gène Rpe65 corrige la mutation pathogène avec une efficacité allant jusqu’à 29 % et avec un minimum d’efficacité. formation d’indel et mutations hors cible, malgré l’absence de la séquence canonique NGG comme motif adjacent au protospacer. Les souris traitées avec l’ABE ont montré une expression restaurée de RPE65 et une activité de l’isomérase rétinoïde, ainsi que des niveaux de fonctions rétiniennes et visuelles proches de la normale. Nos résultats justifient des tests supplémentaires sur l’ABE pour le traitement des maladies héréditaires de la rétine et pour la correction des mutations pathologiques avec des motifs adjacents aux protospaceurs non canoniques. |
Une étude révolutionnaire, menée par des chercheurs de l’Université de Californie à Irvine, aboutit à la restauration des fonctions visuelles et rétiniennes chez des modèles de souris souffrant d’une maladie rétinienne héréditaire.
Publié aujourd’hui dans Nature Biomedical Engineering , l’article intitulé « Restauration de la fonction visuelle chez des souris adultes atteintes d’une maladie rétinienne héréditaire par édition de la base adénine » illustre l’utilisation d’une technologie CRISPR de nouvelle génération et jette les bases du développement d’un nouveau modalité thérapeutique pour un large éventail de maladies oculaires héréditaires causées par différentes mutations génétiques.
"Dans cette étude de validation de principe, nous apportons la preuve du potentiel clinique des éditeurs de base pour corriger les mutations responsables des maladies héréditaires de la rétine et pour restaurer la fonction visuelle", a déclaré Krzysztof Palczewski, PhD, titulaire de la chaire Irving H. Leopold et professeur distingué. au Gavin Herbert Eye Institute, Département d’ophtalmologie, École de médecine UCI. "Nos résultats démontrent le sauvetage le plus réussi de la cécité à ce jour grâce à l’édition du génome."
Les maladies héréditaires de la rétine (MRI) sont un groupe d’affections cécitantes causées par des mutations dans plus de 250 gènes différents. Auparavant, il n’existait aucun moyen de traiter ces maladies dévastatrices et cécitantes. Récemment, la FDA a approuvé la première thérapie d’augmentation génique pour l’amaurose congénitale de Leber (ACL), une forme courante d’IRD qui apparaît pendant l’enfance.
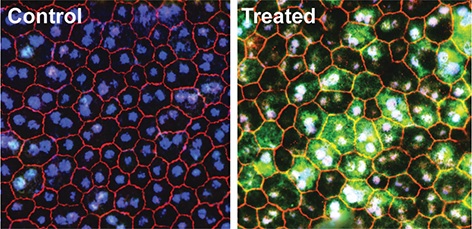
Une mutation dans un modèle murin de cécité héréditaire supprime l’expression de RPE65, une enzyme clé du cycle visuel, dans les cellules RPE. Le traitement d’édition de base peut corriger la mutation et restaurer le RPE65 fonctionnel (vert), rétablissant ainsi la vision chez la souris.
"Comme alternative à la thérapie d’augmentation génique, nous avons appliqué une nouvelle génération de technologie CRISPR, connue sous le nom d’ "édition de base ", comme traitement des maladies héréditaires de la rétine", a déclaré la première auteure, Susie Suh, spécialiste adjointe au département de médecine de l’Institut. Faculté de médecine UCI. Ophtalmologie.
"Nous avons surmonté certaines des barrières du système CRISPR-Cas9, telles que les mutations imprévisibles hors cible et la faible efficacité d’édition, en utilisant des éditeurs de bases de cytosine et d’adénine (CBE et ABE). L’utilisation de ces éditeurs nous a permis de corriger des mutations ponctuelles de manière précise. et prévisible tout en minimisant les mutations involontaires qui pourraient provoquer des effets secondaires indésirables », a déclaré le co-auteur principal Elliot Choi, également spécialiste adjoint au département d’ophtalmologie de l’UCI.
En utilisant un modèle de souris LCA hébergeant une mutation pathogène cliniquement pertinente dans le gène Rpe65, l’équipe de l’UCI a démontré avec succès le potentiel thérapeutique de l’édition de bases pour le traitement de la LCA et, par extension, d’autres maladies héréditaires responsables de la cécité. Entre autres résultats, le traitement d’édition de base a restauré la fonction visuelle et rétinienne des souris LCA à des niveaux proches de la normale.
"Après avoir reçu le traitement, les souris de notre étude ont pu distinguer les changements visuels en termes de direction, de taille, de contraste et de fréquence spatiale et temporelle", a déclaré Palczewski. "Ces résultats sont extrêmement encourageants et représentent une avancée majeure vers le développement de traitements pour les maladies héréditaires de la rétine."
Les approches de thérapie génique pour traiter les maladies héréditaires de la rétine sont particulièrement intéressantes compte tenu de l’accessibilité de l’œil, de son statut immunitaire privilégié et des essais cliniques réussis de la thérapie d’augmentation génique RPE65 qui ont conduit à la première thérapie génique approuvée par l’administration américaine. Aliments et médicaments aux États-Unis
Désormais, comme l’a démontré cette étude, la technologie d’édition de base peut fournir un modèle de traitement alternatif à la thérapie d’augmentation génique pour sauver de façon permanente la fonction d’une protéine clé liée à la vision désactivée par des mutations.