Zusammenfassung Cytosin-Base-Editoren und Adenin-Base-Editoren (ABE) können Punktmutationen vorhersehbar und unabhängig von Cas9-induzierten doppelsträngigen DNA-Brüchen (die eine erhebliche Indel-Bildung verursachen) und homologiegesteuerter Reparatur (die normalerweise zu einer geringen Editierungseffizienz führt) korrigieren. Hier zeigen wir bei erwachsenen Mäusen, dass eine subretinale Injektion eines Adeno-assoziierten Virus, das eine ABE exprimiert, und einer einzelnen Guide-RNA, die auf eine De-novo-Missense-Mutation im Rpe65-Gen abzielt, die pathogene Mutation mit einer Effizienz von bis zu 29 % und mit minimaler Effizienz korrigiert Indel-Bildung und Off-Target-Mutationen, obwohl die kanonische NGG-Sequenz als Motiv neben dem Protospacer fehlt. Mit ABE behandelte Mäuse zeigten eine wiederhergestellte RPE65-Expression und Retinoid-Isomerase-Aktivität sowie nahezu normale Werte der Netzhaut- und Sehfunktionen. Unsere Ergebnisse motivieren zu weiteren Tests von ABE zur Behandlung erblicher Netzhauterkrankungen und zur Korrektur pathologischer Mutationen mit Motiven neben nicht-kanonischen Protospacern. |
Eine bahnbrechende Studie unter der Leitung von Forschern der University of California, Irvine, führt zur Wiederherstellung der Seh- und Netzhautfunktionen bei Mausmodellen, die an einer erblichen Netzhauterkrankung leiden.
Der heute in Nature Biomedical Engineering veröffentlichte Artikel mit dem Titel „Wiederherstellung der Sehfunktion bei erwachsenen Mäusen mit einer vererbten Netzhauterkrankung durch Adeninbase-Editierung“ veranschaulicht den Einsatz einer CRISPR-Technologie der nächsten Generation und legt den Grundstein für die Entwicklung einer neuen Therapiemodalität für ein breites Spektrum erblicher Augenkrankheiten, die durch verschiedene genetische Mutationen verursacht werden.
„In dieser Proof-of-Concept-Studie liefern wir Beweise für das klinische Potenzial von Baseneditoren zur Korrektur von Mutationen, die erbliche Netzhauterkrankungen verursachen, und zur Wiederherstellung der Sehfunktion“, sagte Krzysztof Palczewski, PhD, Irving H. Leopold Chair und angesehener Professor am Gavin Herbert Eye Institute, Abteilung für Augenheilkunde, UCI School of Medicine. „Unsere Ergebnisse zeigen die bisher erfolgreichste Rettung vor der Blindheit durch Genomeditierung.“
Vererbte Netzhauterkrankungen (IRDs) sind eine Gruppe von Erblindungserkrankungen, die durch Mutationen in mehr als 250 verschiedenen Genen verursacht werden. Bisher gab es keine Möglichkeit, diese verheerenden, blind machenden Krankheiten zu behandeln. Kürzlich hat die FDA die erste Gen-Augmentationstherapie für die Leber-kongenitale Amaurose (LCA) zugelassen, eine häufige Form der IRD, die im Kindesalter auftritt.
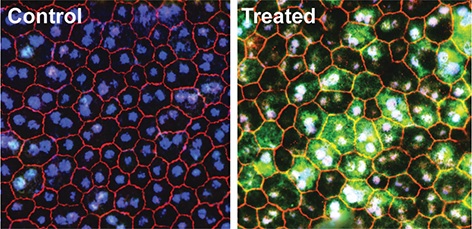
Eine Mutation in einem Mausmodell der erblichen Blindheit unterbindet die Expression von RPE65, einem Schlüsselenzym in einem Sehzyklus, in RPE-Zellen. Eine Base-Editing-Behandlung kann die Mutation korrigieren und das funktionelle RPE65 (grün) wiederherstellen, wodurch das Sehvermögen bei Mäusen wiederhergestellt wird.
„Als Alternative zur Gen-Augmentationstherapie haben wir eine neue Generation der CRISPR-Technologie, bekannt als ‚Base Editing‘ , zur Behandlung erblicher Netzhauterkrankungen eingesetzt“, sagte Erstautorin Susie Suh, Assistenzärztin in der medizinischen Abteilung der Universität Medizinische Fakultät der UCI. Augenheilkunde.
„Wir haben einige der Hindernisse des CRISPR-Cas9-Systems, wie unvorhersehbare Off-Target-Mutationen und geringe Editierungseffizienz, mithilfe von Cytosin- und Adenin-Base-Editoren (CBE und ABE) überwunden. Mithilfe dieser Editoren konnten wir Punktmutationen präzise korrigieren.“ und vorhersehbare Weise zu entwickeln und gleichzeitig unbeabsichtigte Mutationen zu minimieren, die unerwünschte Nebenwirkungen verursachen könnten“, sagte Co-Seniorautor Elliot Choi, ebenfalls Assistenzarzt in der UCI-Abteilung für Augenheilkunde.
Anhand eines LCA-Mausmodells, das eine klinisch relevante pathogene Mutation im Rpe65-Gen trägt, konnte das UCI-Team erfolgreich das therapeutische Potenzial der Baseneditierung für die Behandlung von LCA und damit auch anderer Erbkrankheiten, die zur Erblindung führen, demonstrieren. Unter anderem stellte die Base-Editing-Behandlung die Seh- und Netzhautfunktion bei LCA-Mäusen auf nahezu normale Werte wieder her.
„Nach der Behandlung waren die Mäuse in unserer Studie in der Lage, visuelle Veränderungen hinsichtlich Richtung, Größe, Kontrast sowie räumlicher und zeitlicher Häufigkeit zu unterscheiden“, sagte Palczewski. „Diese Ergebnisse sind äußerst ermutigend und stellen einen großen Schritt vorwärts bei der Entwicklung von Behandlungen für erbliche Netzhauterkrankungen dar.“
Gentherapieansätze zur Behandlung erblicher Netzhauterkrankungen sind angesichts der Zugänglichkeit des Auges, seines immunprivilegierten Status und der erfolgreichen klinischen Studien zur RPE65-Gen-Augmentationstherapie, die zur ersten von der US-Regierung zugelassenen Gentherapie führten, von besonderem Interesse. US-Lebensmittel und Arzneimittel
Wie in dieser Studie gezeigt wurde, könnte die Base-Editing-Technologie nun ein alternatives Behandlungsmodell zur Gen-Augmentationstherapie darstellen, um die Funktion eines wichtigen, mit dem Sehvermögen verbundenen Proteins, das durch Mutationen deaktiviert wurde, dauerhaft wiederherzustellen.