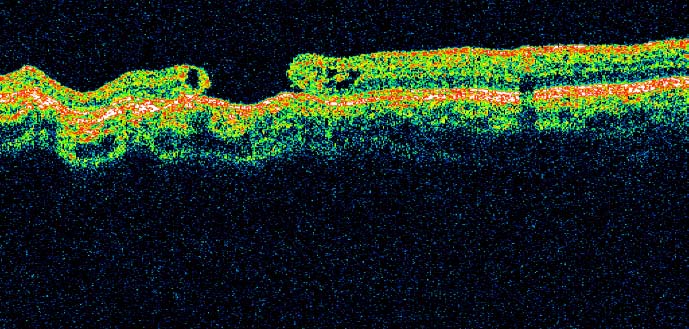
Die optische Kohärenztomographie (OCT) hat sich zu einem wertvollen Instrument zur Beurteilung von Netzhautveränderungen entwickelt, die mit neurodegenerativen Erkrankungen, einschließlich der Parkinson-Krankheit (PD), in Zusammenhang stehen. OCT ermöglicht hochauflösende, reproduzierbare und genaue Messungen der Netzhautschichtdicke, um strukturelle Veränderungen zu erkennen. Unter den Netzhautschichten hat die innere plexiforme Schicht der Ganglienzellen (GCIPL) aufgrund ihres Potenzials als Biomarker für Neurodegeneration und kognitiven Abbau große Aufmerksamkeit auf sich gezogen.
Optische Kohärenztomographie. LaNCE-Neuropharm—GIC 21/133
Zusammenhang zwischen retinaler Neurodegeneration und dem Fortschreiten kognitiver Beeinträchtigungen bei Parkinson
Zusammenfassung
Die Netzhautdicke kann als Biomarker bei der Parkinson-Krankheit (PD) dienen. In dieser prospektiven Längsschnittstudie wollten wir feststellen, ob bei PD-Patienten die innere plexiforme Schicht der parafovealen Ganglienzellen (pfGCIPL) und die peripapilläre retinale Nervenfaserschicht (pRNFL) im Vergleich zu Kontrollpersonen eine beschleunigte Ausdünnungsrate aufweisen. Darüber hinaus untersuchten wir die Beziehung zwischen retinaler Neurodegeneration und klinischem Fortschreiten bei PD.
Eine Kohorte von 156 PD-Patienten und 72 Kontrollpersonen unterzog sich zwischen Februar 2015 und Dezember 2021 in zwei spanischen Tertiärkrankenhäusern einer optischen Kohärenztomographie der Netzhaut sowie visuellen und kognitiven Untersuchungen. Die pfGCIPL-Ausdünnungsrate war bei PD (β [SE] = −0,58 [0,06]) doppelt so hoch wie bei Kontrollpersonen (β [SE] = −0,29 [0,06], p < 0,001). Bei PD war das Fortschreitungsmuster der pfGCIPL-Atrophie von der anfänglichen Dicke abhängig, wobei bei PD-Patienten mit pfGCIPL unter 89,8 µm langsamere Ausdünnungsraten beobachtet wurden. Dieses Ergebnis wurde anhand eines externen Datensatzes des Moorfields Eye Hospital NHS Foundation Trust (AlzEye-Studie) validiert. Bei Patienten mit langsamer Progression der pfGCIPL, die durch ein höheres Ausgangsalter, eine längere Krankheitsdauer und schlechtere Werte für kognitive Fähigkeiten und Krankheitsstadium gekennzeichnet sind, war die Rate des kognitiven Abbaus im Vergleich zu Patienten mit schnellerer Progression dreifach erhöht (β [SE] = − 0,45 [0,19] Punkte/Jahr, p = 0,021). Darüber hinaus war die Ausdünnung der pRNFL des temporalen Sektors bei PD beschleunigt (β Zeit × Gruppe [SE] = −0,67 [0,26] μm/Jahr, p = 0,009), was einen engen Zusammenhang mit den Veränderungen im kognitiven Score zeigt (β [SE] = 0,11 [0,05], p = 0,052).
Diese Studie deutet darauf hin, dass ein langsameres Muster des Verlusts von pfGCIPL-Gewebe bei PD mit einem schnelleren Abbau der kognitiven Fähigkeiten einhergeht, während Veränderungen im temporalen pRNFL auf einen Abbau der kognitiven Fähigkeiten folgen könnten.
Kommentare
Obwohl für die Anwendung im klinischen Umfeld noch einige Aspekte bestätigt werden müssen und die Auflösung noch leicht verbessert werden muss, hat eine Studie der UPV/EHU und Biobizkaia gezeigt, dass eine Methode, die üblicherweise für ophthalmologische Untersuchungen verwendet wird, auch zur Überwachung der Neurodegeneration bei Parkinson-Patienten eingesetzt werden kann .
Im Laufe der Forschung wurde festgestellt, dass eine Neurodegeneration der Netzhaut wahrscheinlich dem Abbau kognitiver Fähigkeiten vorausgeht.
Wenn Parkinson oder eine andere neurodegenerative Erkrankung diagnostiziert wird, fragen sich die Patienten immer: „Was jetzt? Was wird passieren? Was ist von der Krankheit zu erwarten?“ Neurologen können diese Fragen jedoch nicht präzise beantworten, da „die Entwicklung der Patienten normalerweise sehr unterschiedlich ist: Einige erleben im Laufe der Jahre keine Veränderungen, während andere an Demenz erkranken oder im Rollstuhl enden“, erklärt Ane Murueta-Goyena, Forscherin an der Abteilung für Neurowissenschaften der UPV/EHU.
Die Identifizierung von Parkinson-Patienten mit einem Risiko kognitiver Beeinträchtigungen ist heute eine große Herausforderung, aber notwendig, um wirksamere klinische Behandlungen bereitzustellen und klinische Studien zu intensivieren.
Tatsächlich wollte Dr. Ane Murueta-Goyena in Zusammenarbeit mit dem Forschungsteam von Biobizkaia überprüfen, „ob das visuelle System diese Verschlechterung vorhersagen kann , das heißt, was den Patienten in einigen Jahren erwartet.“ Zu diesem Zweck wurde die Dicke der Netzhaut verwendet.
Die Netzhaut ist eine Membran, die sich auf der Rückseite des Augapfels befindet. Sie ist mit dem Nervensystem verbunden und besteht aus mehreren Schichten. Während der Studie wurde die Dicke der innersten Netzhautschicht einer Kohorte von Parkinson-Patienten mittels optischer Kohärenztomographie gemessen.
Diese Art der Tomographie ist ein Instrument, das häufig bei ophthalmologischen Untersuchungen verwendet wird, da es hochauflösende, wiederholbare und präzise Messungen ermöglicht. So wurde die Entwicklung dieser Netzhautschicht im Zeitraum 2015-2021 bei Menschen mit und ohne Parkinson-Krankheit analysiert und verglichen. Die Ergebnisse der Analyse von Bildern der Netzhautschichten von Parkinson-Patienten wurden auch in einem Krankenhaus im Vereinigten Königreich bestätigt.
Die Ergebnisse zeigten, dass die Netzhautschicht bei Parkinson-Patienten deutlich dünner ist . Außerdem wurde beobachtet, dass „während der Anfangsphasen der Krankheit die größte Neurodegeneration in der Netzhaut festgestellt wird und ab einem bestimmten Zeitpunkt, wenn die Schicht bereits sehr dünn ist, eine Art Stabilisierung des Neurodegenerationsprozesses eintritt.“
„Netzhautverdünnung und kognitive Beeinträchtigung treten nicht gleichzeitig auf. Die anfänglichen Veränderungen der Netzhaut sind deutlicher, und dann, im Laufe der Jahre, beobachtet man bei den Patienten eine klinische Verschlechterung sowohl in kognitiver als auch in motorischer Hinsicht“, erklärte Murueta-Goya. „Mit anderen Worten, ein langsamerer Verlust der Netzhautschichtdicke ist mit einem schnelleren kognitiven Verfall verbunden; diese Langsamkeit hängt mit einer größeren Schwere der Krankheit zusammen.“
Der Forscher hat den Ergebnissen große Bedeutung beigemessen. „Wir haben Informationen über den Krankheitsverlauf erhalten und das von uns vorgeschlagene Tool ist nicht invasiv und in allen Krankenhäusern verfügbar.“
Die Ergebnisse müssen international validiert werden und „indem wir die Auflösung der Technologie leicht verbessern, kommen wir der Validierung der Methode zur Überwachung der Neurodegeneration, die bei der Parkinson-Krankheit auftritt, näher.“ Der Forscher gab auch bekannt, dass die Forschung an einer weiteren Patientengruppe fortgesetzt wird und dass die Finanzierung der Schlüssel ist.
Diskussion
Diese longitudinale Kohortenstudie ergab, dass die Rate der Netzhautverdünnung bei PD-Patienten im Vergleich zu Kontrollpersonen signifikant höher war, insbesondere bei pfGCIPL und dem temporalen Sektor von pRNFL. Unsere Ergebnisse deuten darauf hin, dass die Rate der retinalen Neurodegeneration bei Menschen mit PD variiert. Insbesondere wiesen PD-Patienten mit stärkerer pfGCIPL-Atrophie zu Beginn eine langsamere pfGCIPL-Ausdünnungsrate im Laufe der Zeit auf. Diese Personen hatten eine längere Krankheitsdauer und einen höheren Krankheitsschweregrad, wie durch kognitive Bewertungen (MoCA) und motorische Bewertungen (H&Y-Skala) festgestellt wurde. Interessanterweise schritt der kognitive Abbau in dieser Gruppe schwerer PD-Patienten mit Netzhautatrophie zu Beginn und langsamerer pfGCIPL-Ausdünnung signifikant schneller voran als bei anderen PD-Patienten. Dieser Befund unterstreicht eine entkoppelte Progression zwischen Makulaveränderungen und kognitivem Abbau und legt nahe, dass die Makulaneurodegeneration dem kognitiven Abbau vorausgehen kann.
Daher gehen wir davon aus, dass es, sobald ein bestimmter Schwellenwert der retinalen Makulaatrophie erreicht ist, zu einer möglichen Verlangsamung ihres Degenerationsmusters kommt. Diese Verlangsamung spiegelt einen größeren Schweregrad der Krankheit wider, der mit einer Beschleunigung des Fortschreitens des kognitiven Abbaus einhergeht. Im Gegensatz dazu zeigte die Ausdünnung im temporalen Sektor der pRNFL eine enge Verbindung mit Veränderungen des MoCA-Scores, was auf ein gleichzeitiges Fortschreiten hindeutet, das als wertvoller Indikator zur Überwachung des kognitiven Abbaus dienen könnte.
Referenz: Ane Murueta-Goyena et al, Zusammenhang zwischen retinaler Neurodegeneration und dem Fortschreiten des kognitiven Abbaus bei Parkinson-Krankheit , npj Parkinson-Krankheit (2024). DOI: 10.1038/s41531-024-00637-x