Arrière-plan
La sécurité cardiovasculaire du traitement de remplacement de la testostérone chez les hommes d’âge moyen et plus âgés souffrant d’hypogonadisme n’a pas été déterminée.
Méthodes
Dans un essai de non-infériorité multicentrique, randomisé, en double aveugle, contrôlé par placebo, nous avons recruté 5 246 hommes âgés de 45 à 80 ans qui présentaient un risque élevé ou préexistant de maladie cardiovasculaire et qui ont signalé des symptômes d’hypogonadisme et avaient deux niveaux de testostérone à jeun de moins de 300 ng par décilitre.
Les patients ont été répartis au hasard pour recevoir quotidiennement un gel transdermique de testostérone à 1,62 % (dose ajustée pour maintenir les niveaux de testostérone entre 350 et 750 ng par décilitre) ou un gel placebo.
Le principal critère d’évaluation de la sécurité cardiovasculaire était la première apparition d’un composant d’un composite de décès cardiovasculaire, d’infarctus du myocarde non mortel ou d’accident vasculaire cérébral non mortel, évalué dans une analyse du délai d’apparition de l’événement.
Un critère d’évaluation cardiovasculaire secondaire était la première apparition d’un composant du composite de décès cardiovasculaire, d’infarctus du myocarde non mortel, d’accident vasculaire cérébral non mortel ou de revascularisation coronarienne, évalué dans une analyse du délai d’apparition de l’événement. La non-infériorité exigeait une limite supérieure inférieure à 1,5 pour l’intervalle de confiance à 95 % du rapport de risque chez les patients ayant reçu au moins une dose de testostérone ou de placebo.
Résultats
La durée moyenne (± ET) du traitement était de 21,7 ± 14,1 mois et le suivi moyen était de 33,0 ± 12,1 mois. Un événement cardiovasculaire principal est survenu chez 182 patients (7,0 %) dans le groupe testostérone et 190 patients (7,3 %) dans le groupe placebo (risque relatif, 0,96 ; intervalle de confiance à 95 %, 0,78 à 1,17 ; P < 0,001 pour la non-infériorité).
Des résultats similaires ont été observés dans des analyses de sensibilité dans lesquelles les données sur les événements survenus à différents moments après l’arrêt de la testostérone ou du placebo ont été censurées.
L’incidence des événements liés au critère d’évaluation secondaire ou de chacun des événements composites du critère d’évaluation cardiovasculaire principal semblait être similaire dans les deux groupes . Une incidence plus élevée de fibrillation auriculaire, de lésions rénales aiguës et d’embolie pulmonaire a été observée dans le groupe testostérone.
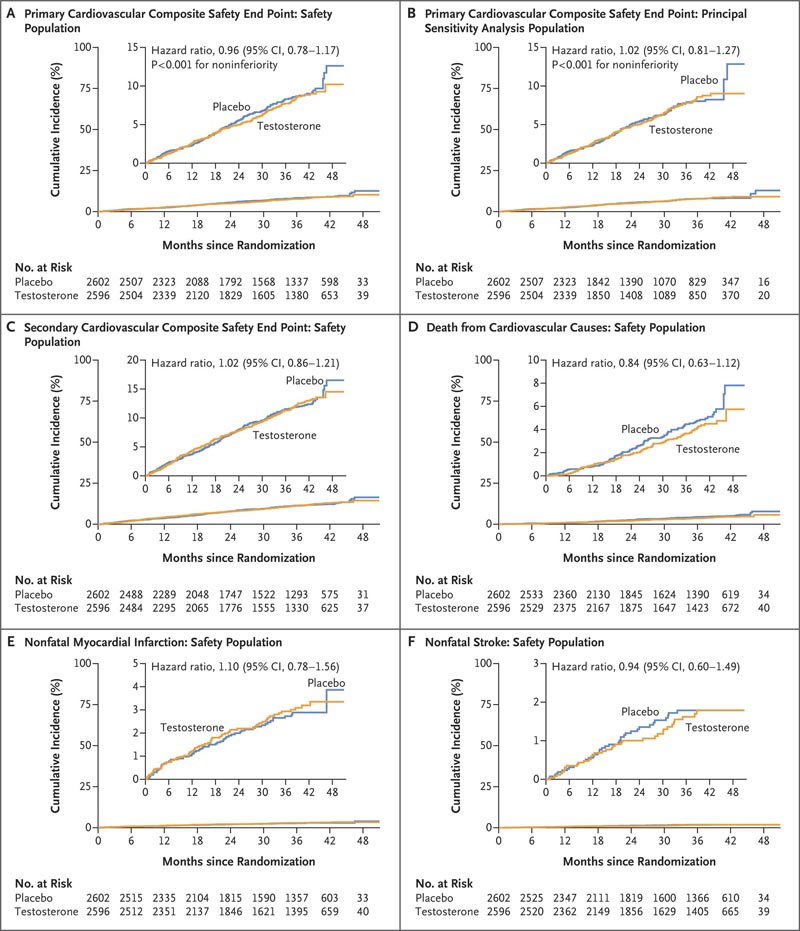
Figure : Analyse du délai avant événement pour les critères d’évaluation primaires et secondaires de sécurité cardiovasculaire . Le panneau A montre l’incidence cumulée du principal critère composite de sécurité cardiovasculaire, défini comme le décès d’origine cardiovasculaire, l’infarctus du myocarde non mortel ou l’accident vasculaire cérébral non mortel. Le panneau B montre l’incidence cumulée du principal critère composite de sécurité cardiovasculaire dans la population de l’analyse de sensibilité primaire dans laquelle les données sur les événements du critère d’évaluation survenus plus de 365 jours après l’arrêt ont été censurées. testostérone ou placebo. Le panneau C montre l’incidence cumulée du critère composite secondaire de sécurité cardiovasculaire que sont la mort cardiovasculaire, l’infarctus du myocarde non mortel, l’accident vasculaire cérébral non mortel ou la revascularisation coronarienne ; Panel D, l’incidence cumulée des décès dus à des causes cardiovasculaires ; Panel E, l’incidence cumulée des infarctus du myocarde non mortels ; et Panel F, l’incidence cumulée des accidents vasculaires cérébraux non mortels. Dans chaque cas, l’incidence cumulée a été estimée avec la méthode de Kaplan-Meier et le rapport de risque a été calculé avec le modèle de régression à risques proportionnels de Cox avec ajustement pour les maladies cardiovasculaires préexistantes (oui ou non) comme covariable. Étant donné que le plan d’analyse statistique ne prévoyait pas de correction de la multiplicité lors des tests de critères secondaires ou autres, les résultats sont présentés sous forme d’estimations ponctuelles et d’intervalles de confiance à 95 %. Les largeurs des intervalles de confiance n’ont pas été ajustées en fonction de la multiplicité, de sorte que les intervalles ne doivent pas être utilisés pour déduire les effets définitifs du traitement pour les critères d’évaluation secondaires. Les encarts affichent les mêmes données sur un axe Y agrandi.
Conclusions Chez les hommes souffrant d’hypogonadisme et d’une maladie cardiovasculaire préexistante ou présentant un risque élevé de maladie cardiovasculaire, le traitement de remplacement de la testostérone n’était pas inférieur au placebo en ce qui concerne l’incidence des événements cardiaques indésirables majeurs. |
(Financé par AbbVie et al. ; numéro TRAVERSE ClinicalTrials.gov, NCT03518034. s’ouvre dans un nouvel onglet.)
















