La maladie 2019 (Covid-19) de coronavirus, la maladie provoquée par le coronavirus 2 (SARS-CoV-2) de syndrome respiratoire aigu sévère, a été identifiée pour la première fois en décembre 2019 et a rapidement progressé pour devenir une pandémie mondiale.
Les personnes âgées et celles souffrant de maladies coexistantes telles que l’obésité, les maladies cardiovasculaires et le diabète sucré courent un risque plus élevé d’hospitalisation ou de décès à cause du Covid-19. Certains traitements comme les anticorps monoclonaux réduisent le risque de progression du Covid-19. Des options thérapeutiques supplémentaires pourraient bénéficier aux patients et alléger le fardeau des systèmes de santé.
Le remdesivir est un inhibiteur nucléotidique à action directe de l’ARN polymérase ARN-dépendante du SRAS-CoV-2 ; a une puissante activité nanomolaire dans les cellules épithéliales primaires des voies respiratoires humaines. Un essai de phase 3 sur le remdesivir a montré qu’une cure de 10 jours et une cure de 5 jours de remdesivir raccourcissaient le temps de récupération chez les patients hospitalisés pour Covid-19.
Le traitement précoce d’autres infections virales aiguës améliore les résultats cliniques et réduit la mortalité, et cette stratégie a également été proposée pour le Covid-19. Nous avons émis l’hypothèse que l’instauration plus précoce d’un traitement de courte durée par le remdesivir en ambulatoire réduirait les hospitalisations et la mortalité.
Nous rapportons ici les résultats d’un essai en double aveugle, randomisé et contrôlé par placebo qui a évalué l’efficacité et la sécurité d’un traitement de 3 jours par remdesivir chez des patients non hospitalisés à haut risque atteints de Covid-19.
Arrière-plan
Le remdesivir améliore les résultats cliniques chez les patients hospitalisés atteints de la maladie à coronavirus 2019 (Covid-19) modérée à sévère. On ne sait pas si l’utilisation du remdesivir chez les patients symptomatiques non hospitalisés atteints de Covid-19 et présentant un risque élevé de progression de la maladie empêche l’hospitalisation.
Méthodes
Nous avons mené un essai randomisé, en double aveugle, contrôlé par placebo chez des patients non hospitalisés atteints de Covid-19 ayant présenté des symptômes au cours des 7 jours précédents et présentant au moins un facteur de risque de progression de la maladie (âge ≥ 60 ans, obésité ou certaines conditions médicales coexistantes).
Les patients ont été répartis au hasard pour recevoir du remdesivir par voie intraveineuse (200 mg le jour 1 et 100 mg les jours 2 et 3) ou un placebo.
Le critère principal d’évaluation de l’efficacité était un critère composite d’hospitalisation ou de décès quelle qu’en soit la cause liée au COVID-19 au jour 28. Le critère principal d’évaluation de la sécurité était tout événement indésirable. Un critère d’évaluation secondaire était une combinaison d’une visite médicale liée à Covid-19 ou d’un décès quelle qu’en soit la cause au jour 28.
Résultats
Au total, 562 patients randomisés et ayant reçu au moins une dose de remdesivir ou de placebo ont été inclus dans les analyses : 279 patients dans le groupe remdesivir et 283 dans le groupe placebo.
L’âge moyen était de 50 ans, 47,9 % des patients étaient des femmes et 41,8 % étaient hispaniques ou latino-américains. Les affections coexistantes les plus courantes étaient le diabète sucré (61,6 %), l’obésité (55,2 %) et l’hypertension (47,7 %).
Des hospitalisations ou des décès liés au COVID-19, quelle qu’en soit la cause, sont survenus chez 2 patients (0,7 %) dans le groupe remdesivir et 15 (5,3 %) dans le groupe placebo (risque relatif, 0,13 ; intervalle de confiance [IC] à 95 %, 0,03 à 0,59). ; P=0,008).
Au total, 4 patients sur 246 (1,6 %) dans le groupe remdesivir et 21 sur 252 (8,3 %) dans le groupe placebo ont eu une visite médicale liée au Covid-19 au jour 28 (rapport de risque, 0,19 ; IC à 95 %, 0,07). à 0,56).
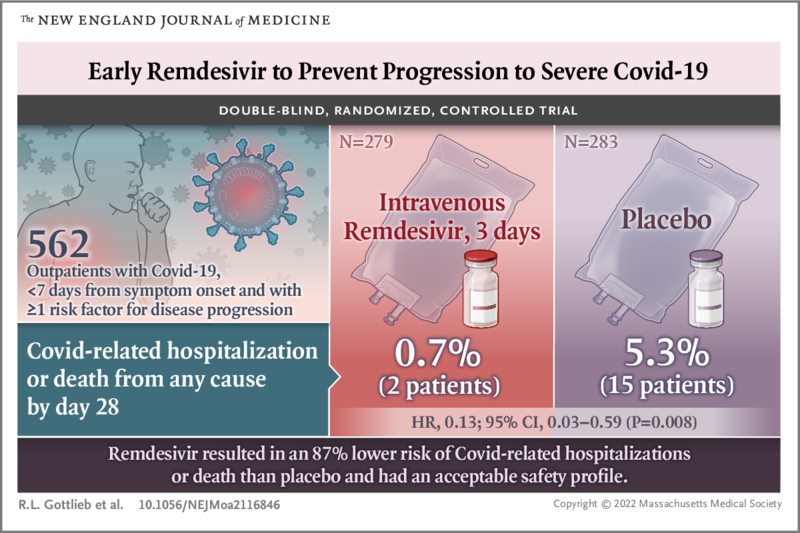
Conclusions Parmi les patients non hospitalisés qui présentaient un risque élevé de progression de Covid-19, une cure de 3 jours de remdesivir avait un profil d’innocuité acceptable et entraînait un risque d’hospitalisation ou de décès 87 % inférieur à celui du placebo. |
(Financé par Gilead Sciences ; numéro PINETREE ClinicalTrials.gov, NCT04501952. s’ouvre dans un nouvel onglet ; numéro EudraCT, 2020-003510-12. s’ouvre dans un nouvel onglet.)