Le manifestazioni extrapolmonari della sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) sono ormai ampiamente riconosciute e hanno importanti implicazioni cliniche. A nostra conoscenza, l’associazione di SARS-CoV-2 con i muscoli respiratori non è stata studiata. Ciò è sorprendente, poiché i muscoli respiratori guidano la ventilazione alveolare e la loro debolezza provoca insufficienza respiratoria acuta.
Nei pazienti critici sottoposti a ventilazione, la debolezza dei muscoli respiratori prolunga la ventilazione meccanica e aumenta la mortalità.
L’ obiettivo di questo studio era di studiare l’associazione tra la grave malattia da coronavirus 2019 (COVID-19) e i muscoli respiratori in pazienti critici e confrontare i risultati con quelli ottenuti da pazienti critici non-COVID-19.
Metodi
Il nostro studio si è concentrato sul diaframma , il principale muscolo respiratorio. Campioni consecutivi di muscolo del diaframma sono stati raccolti durante l’autopsia dai cadaveri di 26 pazienti che erano stati gravemente malati di COVID-19 in 3 centri medici accademici nei Paesi Bassi (noti come COVID-19 - unità di terapia intensiva [ICU]). nei mesi di aprile e maggio 2020.
Come gruppo di controllo , sono stati raccolti campioni di diaframma autoptico dai cadaveri di 8 pazienti che erano stati gravemente malati senza COVID-19 (definiti unità di terapia intensiva di controllo).
Per le analisi sono stati utilizzati campioni prelevati dal diaframma mediocostale sinistro.
Questo studio è stato approvato dal comitato di etica medica dell’UMC di Amsterdam e il parente più prossimo del defunto ha fornito il consenso informato scritto. I dati sono stati analizzati con SPSS, versione 22 (IBM) e visualizzati con GraphPad Prism, versione 7.0 (GraphPad). La significatività statistica è stata fissata a p <0,05.
Risultati
L’età media dei pazienti affetti da COVID-19 in terapia intensiva era di 71 anni (intervallo interquartile, 61-74 anni) e 21 (81%) erano uomini.
Ventiquattro pazienti (92,3%) hanno ricevuto ventilazione meccanica invasiva per una media di 12 giorni (intervallo interquartile, 6-25 giorni). Il numero di giorni sottoposti a ventilazione meccanica invasiva e la durata della degenza in terapia intensiva erano comparabili tra i pazienti affetti da COVID-19 in terapia intensiva e quelli di controllo in terapia intensiva.
COVID-19: i pazienti in terapia intensiva avevano un indice di massa corporea più elevato (calcolato come peso in chilogrammi diviso per altezza in metri quadrati) e avevano meno probabilità di essere trattati con steroidi.
Nessun paziente in nessuno dei due gruppi aveva una malattia neuromuscolare preesistente.
Riportiamo l’enzima 2 di conversione dell’angiotensina (ACE-2) nel diaframma di pazienti con COVID-19 - terapia intensiva e controllo - terapia intensiva. L’ACE-2 è prevalentemente localizzato sulla membrana delle miofibre, fornendo un punto di ingresso per SARS-CoV-2 per infettare le miofibre del diaframma. Prove di RNA virale SARS-CoV-2 sono state trovate nel diaframma in 4 pazienti (15,4%).
Ulteriori analisi, per le quali abbiamo applicato l’ ibridazione in situ dell’RNA , hanno indicato che l’RNA virale era localizzato all’interno delle miofibre del diaframma. Le analisi di sequenziamento dell’RNA hanno mostrato che 315 geni erano sovraregolati e 281 sottoregolati nel diaframma dei pazienti in terapia intensiva con COVID-19 rispetto ai pazienti in terapia intensiva di controllo.
Ulteriori analisi di tutti i geni sovraregolati e sottoregolati hanno rivelato l’attivazione dei percorsi della fibrosi (segnalazione del fattore di crescita dei fibroblasti).
Coerentemente con questi risultati, la fibrosi epimisiale e perimisiale era più di 2 volte più elevata nei diaframmi dei pazienti in terapia intensiva con COVID-19 rispetto ai pazienti in terapia intensiva di controllo.
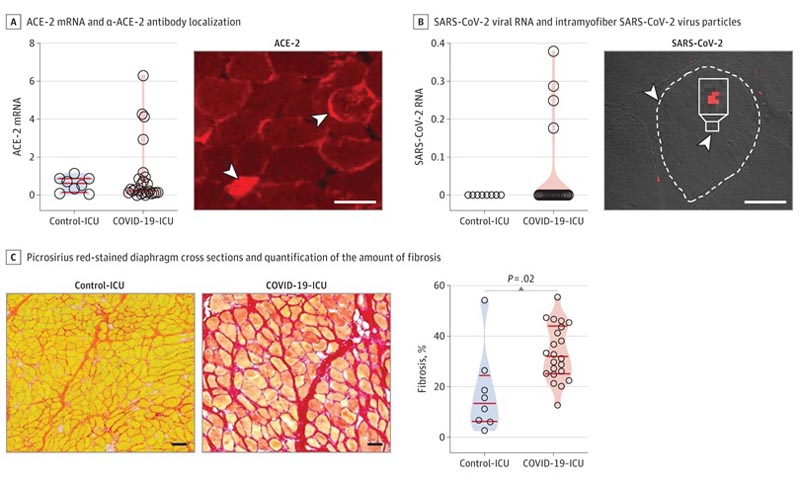
A, pannello di sinistra: mRNA di ACE-2 in campioni di diaframma determinato mediante reazione a catena della polimerasi quantitativa (qPCR) e normalizzato per il gene housekeeping TBP. Pannello di destra: localizzazione dell’anticorpo α-ACE-2 con microscopia a fluoresceina in sezioni trasversali del diaframma; le punte delle frecce mostrano la localizzazione citosolica e di membrana (barra = 50 μm). B, Pannello di sinistra: L’RNA virale della sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2), determinato mediante qPCR e normalizzato per il gene housekeeping TBP, viene rilevato nel diaframma di 4 coronavirus 2019 (COVID-19) - unità di terapia intensiva (ICU) pazienti (pazienti 7, 9, 33 e 36). Pannello di destra: l’ibridazione in situ utilizzando l’RNAscopio nel paziente n. 7 mostra particelle di virus SARS-CoV-2 intramifibra (punti rossi, indicati con punte di freccia); un bordo della miofibra è evidenziato con una linea tratteggiata (barra = 30 μm). C, pannelli di sinistra: immagini rappresentative di sezioni trasversali del diaframma colorate di rosso picrosirius per evidenziare la fibrosi; vengono mostrati i pazienti n. 22 e 3 (barra = 100 μm). Pannello di destra: quantificazione della quantità di fibrosi.
Discussione
In questo studio, forniamo prove uniche dell’espressione di ACE-2 nel diaframma umano e dell’infiltrazione virale SARS-CoV-2 nel diaframma di un sottogruppo di pazienti COVID-19 – terapia intensiva.
Nei pazienti con COVID-19 - terapia intensiva, riportiamo una maggiore espressione di geni coinvolti nella fibrosi e prove istologiche per lo sviluppo di fibrosi nel diaframma. Questo fenotipo miopatico era chiaramente diverso da quello dei pazienti di controllo in terapia intensiva, con durata comparabile di ventilazione meccanica e degenza in terapia intensiva.
Resta da stabilire se la miopatia diaframmatica sia un effetto diretto della SARS-CoV-2. Solo 3 pazienti nel gruppo di controllo in terapia intensiva (37,5%) avevano una malattia polmonare virale e l’associazione della polmonite virale con i muscoli del diaframma non è nota.
| Ipotizziamo che la grave miopatia diaframmatica associata a COVID-19, come descritta in questo studio, possa portare a debolezza del diaframma e potrebbe contribuire al fallimento dello svezzamento del ventilatore, alla dispnea persistente e all’affaticamento nei pazienti con COVID-19 che sopravvivono alla loro permanenza in terapia intensiva . |