| 1. Einleitung |
Melanozyten stammen aus Vorläuferzellen der Neuralleiste während der Embryonalentwicklung und sind pigmentierte Zellen, die als lichtschützende Reaktion Melanin produzieren. Obwohl Melanozyten am häufigsten in Haut und Haaren zu finden sind, kommen sie auch auf Schleimhautoberflächen und im Uvealtrakt des Auges vor. Die klonale Proliferation von Melanozyten in diesen jeweiligen anatomischen Regionen führt zu Haut-, Schleimhaut- und Aderhautmelanomen.
Zu den wichtigsten Risikofaktoren für kutane Melanome zählen die chronische Exposition gegenüber ultravioletten (UV) Strahlen bei älteren Erwachsenen und blasenbildende Sonnenbrände im Jugend- und Kindesalter; Dies wird durch die UV-bedingten C > T-Nukleotidsubstitutionen gestützt, die in der Genetik kutaner Melanome vorherrschen. Auf molekularer Ebene ist dieser bösartige Übergang von Melanozyten zum Melanom charakterisiert und hängt offenbar von der konstitutiven Aktivierung des RAS-RAF-MAPK/ERK-Signalwegs ab, der Zellproliferation, Invasion, Angiogenese und Metastasierung reguliert.
Die Identifizierung von Treibermutationen wie BRAFv600E/K auf diesem Weg hat zur Entwicklung einer gezielten Therapie mit doppelter Hemmung von BRAF und MEK geführt, die zu einer deutlichen Verbesserung des Gesamtüberlebens von Melanompatienten beigetragen hat. erweiterte BRAF V600 ( Abbildung 1 ).
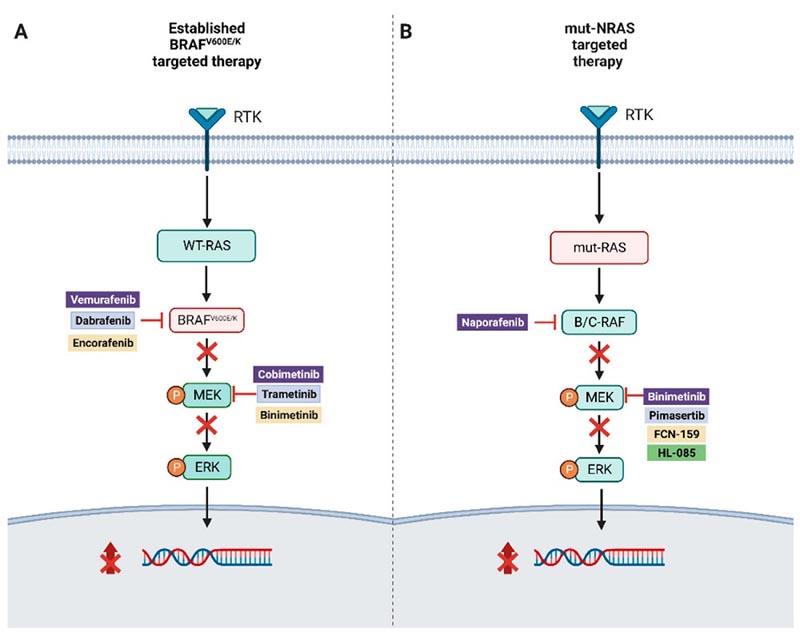
Abbildung 1.
( A ) Darstellung einer kombinierten gezielten Therapie bei BRAFv600E/K-mutiertem Melanom.
( B ) Gezielte Therapieansätze für NRAS-mutiertes Melanom.
Die Therapielandschaft für Melanome hat sich seit den Tagen, als die Prognose für Patienten mit fortgeschrittenem metastasiertem Melanom in Monaten gemessen wurde und Dacarbazin und Interleukin-2 die einzigen von der FDA zugelassenen Behandlungsoptionen waren, stark weiterentwickelt. Das Aufkommen der Immun-Checkpoint-basierten Immuntherapie als Erstlinienbehandlung hat die Ergebnisse erheblich verändert. In dieser Übersicht beleuchten die Autoren die jüngsten Fortschritte bei gezielten Melanomtherapien.
| 2. RAF-Mutationen über MAPK |
Beim Melanom liegen die molekularen Ziele größtenteils im MAPK-Signalweg, der für das Fortschreiten des Melanoms entscheidend zu sein scheint. Der Signalweg reguliert ein breites Spektrum zellulärer Aktivitäten, einschließlich Zellproliferation, Überleben, Angiogenese und Migration. Die RAF-Proteinfamilie besteht aus drei Enzymen: ARAF, BRAF und CRAF (RAF-1). Mutationen sind in etwa 8 % der menschlichen Tumoren vorhanden, wobei BRAF-aktivierende somatische Mutationen bei 40–66 % der Melanome vorliegen.
| 3. BRAF-Mutantenresistenz |
Die erworbene Resistenz mit klinischem Rückfall ist bei allen mit der BRAF/MEK-Inhibitor-Kombination behandelten Patienten nahezu einheitlich. Dies ist teilweise auf zahlreiche Arzneimittelresistenzmechanismen zurückzuführen, die eine wirksame Vorbeugung oder Behandlung erschweren.
| 4. Pan-RAF-Inhibitoren |
Pan-RAF-Inhibitoren wurden als alternativer Ansatz zur Verhinderung oder Überwindung von Resistenzen und paradoxer Aktivierung spezifischer BRAF-Inhibitoren bei BRAF-WT- und NRAS-mutierten Patienten sowie in der Untergruppe von BRAF-V600E-mutierten Patienten mit Resistenz entwickelt. erworben.
Da frühe Studien eine begrenzte klinische Wirksamkeit der Pan-RAF-Monotherapie zeigten, wurden Resistenzmechanismen anhand behandelter Melanomzellen aufgeklärt, die schließlich eine Resistenz gegen Belvarafenib, einen Pan-RAF-Inhibitor, entwickelten. In vitro wurde festgestellt, dass bei Belvarafenib-resistenten Klonen der MAPK-Signalweg durch Mutationen im ARAF reaktiviert wird, was zu Dimerisierung und Kinaseaktivität führt. In vivo wurde auch festgestellt, dass ctDNA, die von Patienten mit fortschreitender Erkrankung nach der Behandlung mit Belvarafenib gewonnen wurde, ARAF-Mutationen aufwies.
| 5. NRAS |
NRAS ist eines von drei Proteinen in der RAS-Proteinfamilie, die bei Bindung an GTP in ihrer aktiven Form und bei Bindung an GDP in ihrer inaktiven Form vorliegen. Aktivierte RAS-Proteinsignale über die MAP-Kinase-Kaskade fördern proliferative und antiapoptotische Aktivitäten. NRAS ist nach BRAF die zweithäufigste Treibermutation beim kutanen Melanom und kommt in 25 bis 30 % der Fälle vor. Diese Mutationen treten häufig im Exon 2 auf und führen zu einer AA-Substitution an Position 61 (Glutamin zu Arginin, Lysin oder Histidin).32]. Die häufigsten onkogenen Mutationen bei RAS beeinträchtigen die Rückkehr von RAS in einen inaktiven GDP-gebundenen Zustand, der durch GTPase-aktivierende Proteine katalysiert wird.
NRAS-mutierte Patienten mit fortgeschrittenem Melanom zum Zeitpunkt der Diagnose haben eine deutlich kürzere Gesamtüberlebenszeit (15,5 Monate gegenüber 23,5 Monaten). Trotz seiner Prävalenz und Bedeutung bei Melanomen hat sich RAS in der Vergangenheit aufgrund des Fehlens einer leicht pharmakologischen Behandlung nicht als geeignet für eine direkte Behandlung erwiesen. GTP-kompetitive Medikamente sind durch die extrem hohe Affinität von RAS zu GTP und hohe intrazelluläre Konzentrationen von GTP begrenzt.
| 6. ERK |
ERK, ein nachgeschalteter Effektor des MAPK-Signalwegs, katalysiert die Phosphorylierung nuklearer Transkriptionsfaktoren, sobald es in seinem aktiven Zustand ist. Die ERK-Signalübertragung beim Melanom wird aufgrund von Mutationen in BRAF und NRAS unabhängig von Rückkopplungsmechanismen. Darüber hinaus bleibt die ERK-Signalübertragung aufgrund der intrinsischen Rückkopplungsregulation durch DUSP-Transkription ohne Hyperaktivierung und anschließendem Stillstand oder Tod des Zellzyklus erhalten. Bei Patienten, die eine Resistenz gegen die RAF- und MEK-Hemmung entwickeln, wird die ERK-Signalisierung wiederhergestellt, was das Interesse weckt, ERK direkt zur Bekämpfung der Resistenz einzusetzen.
| 7. Atypische BRAF-Mutationen |
Melanome mit atypischer BRAF-Mutation umfassen eine vielfältige genetische Veränderung und werden häufig in V600- und Nicht-V600-Mutanten unterteilt. Jede Mutation wird auf der Grundlage ihres Signalmechanismus und ihrer Kinaseaktivität in die Klassen I, II oder III eingeteilt, was zu unterschiedlichen Graden der molekularen Deregulierung führt. Bei den seltenen Mutationen BRAF V600 einschließlich V600R/D/M/L handelt es sich um Kinase-aktivierende Monomere, die charakteristischerweise bei älteren männlichen Patienten mit chronischen Sonnenschäden in der Vorgeschichte vorkommen. Nicht-V600-Mutanten können je nach Dimerbildung in Klasse II (z. B. L597P/Q/R/S, K601E, G469R/S/A) oder III (G596R, D594Y/N/G/E, D287Y) eingeteilt werden um RAF-Kinasen oder Heterodimere zu aktivieren, die die Kinaseaktivität vollständig verändern, was jeweils zu einer paradoxen Aktivierung der ERK-Signalisierung führt.
Typischerweise haben Tumoren der Klassen II und III einen aggressiveren klinischen Verlauf und sind mit einer schlechteren Prognose verbunden. Atypische BRAF-Mutationen treten am häufigsten bei Schleimhautmelanomen auf.
| 8. Hemmung von MEK CDK4/6 + |
Fünfzig Prozent der NRAS-mutierten Melanome weisen genetische Aberrationen in zellzyklusassoziierten Genen auf, was einen Grund für die Kombination von MEK-Inhibitoren mit CDK4/6-Inhibitoren darstellt. CDK4/6-Inhibitoren verursachen einen Stillstand des Zellzyklus, indem sie verhindern, dass der CDK4/6-Cyclin-D1-Komplex das Retinoblastom-Protein phosphoryliert. Eine präklinische Studie mit NRAS-mutierten menschlichen Melanomzelllinien zeigte synergistische Effekte sowohl auf die Apoptose als auch auf den Stillstand des Zellzyklus mit entsprechender Tumorregression. Derzeit läuft eine Phase-II-Studie zur Bewertung der Wirksamkeit des Pan-RAF-Inhibitors Naporafenib in Kombination mit Ribociclib bei Patienten mit metastasiertem oder inoperablem NRAS-mutiertem Melanom.
| 9 . SHP2 |
Die Protein-Tyrosin-Phosphatase 2, kurz SHP2, ist in jüngster Zeit die Grundlage für neue zielgerichtete Therapieansätze. SHP2 fungiert als Protein-Tyrosinphosphatase und ist an der Aktivierung mehrerer Signalwege beteiligt, darunter RAS/Raf/MAPK, PI3K/AKT, JAK/STAT und PD-1/PD-L1. Folglich kann die Modulation der SHP2-Aktivität das Zellüberleben und die Immunregulationswege beeinflussen.
| 10. Autophagie |
Melanome, die eine Resistenz gegen BRAF plus MEK-Hemmung entwickelt haben, sind häufig durch eine schnell fortschreitende Erkrankung gekennzeichnet. Einer der identifizierten Resistenzmechanismen ist die Autophagie, ein adaptiver zellulärer Prozess, bei dem abnormale Proteine, beschädigte Organellen und Krankheitserreger durch lysosomalen Abbau abgebaut werden, um Zellbestandteile in molekulare Vorläufer und Energie umzuwandeln und so die Selbsterneuerung zu erleichtern.
Insbesondere erhöht die MEK1/2-Hemmung den autophagischen Fluss durch Aktivierung der LKB1-AMPK-ULK1-Signalachse in RAS-gesteuerten Krebszellen. Daher ist Autophagie zu einem rationalen Ziel zur Überwindung der BRAF/MEK-Resistenz geworden.
| 11 . Epigenetische Ziele |
EZH2 kodiert für eine katalytische Untereinheit des Polycomb Repressive Complex 2 (PRC2), der die Trimethylierung von Histon H3 Lysin 27 erleichtert. PRC2 spielt eine Schlüsselrolle bei der epigenen Regulation, indem es die Chromatinverdichtung fördert. EZH2 wird in primären und metastasierten Melanomen des Menschen stark exprimiert und gilt als notwendig für die Melanogenese, Proliferation und Metastasierung; seine Ausprägung ist mit einer schlechteren Prognose verbunden. Punktmutationen von EZH2 führen bei 5 % der Melanome zu einem Funktionsgewinn und werden häufig in Koexistenz mit BRAF-Aktivatoren gefunden, was auf einen onkogenen Synergismus hinweisen kann.
| 12. BAP1 und HDAC |
BRCA1-assoziiertes Protein 1 (BAP1) ist ein Tumorsuppressorgen, das in metastasierten Aderhautmelanomen in den späten Stadien der Melanomagenese häufig mutiert ist. Die Mutation führt zu einem Verlust der Genfunktion und veranlasst die Zellen, sich zu dedifferenzieren und stammähnliche Eigenschaften mit größerer Fähigkeit zur Selbstreplikation zu erwerben. Veränderungen der epigenetischen Regulationen tragen zu diesem Phänotyp bei, wie die Wiederherstellung der Melanozytendifferenzierung zeigt, wenn Aderhautmelanomzellen mit BAP1-Mutationen mit Histondeacetylase (HDAC)-Inhibitoren behandelt werden. Die klinische Wirksamkeit von HDAC-Inhibitoren wurde jedoch nicht nachgewiesen.
| 13. Verbesserte Immuntherapie |
Das Aufkommen der Immuntherapie stellt seit den ersten Versuchen mit systemischer Therapie vor vielen Jahren den bedeutendsten Fortschritt in der Versorgung von Patienten mit fortgeschrittenem Melanom dar. Obwohl berichtet wurde, dass die mittlere Überlebenszeit bei Patienten, die mit der Ipilimumab/Nivolumab-Kombination behandelt wurden, bis zu 72,1 Monate beträgt, kann dieser Ansatz durch erhebliche behandlungsbedingte immunologische Nebenwirkungen und die Entwicklung von Resistenzen eingeschränkt werden.
Es wurden mehrere neuartige Ansätze verfolgt, um Immuntherapie mit zielgerichteten Therapiewirkstoffen zu kombinieren, um Resistenzen zu überwinden und die Ergebnisse zu verbessern. Ein bewährter Ansatz besteht darin, die immunsuppressive Wirkung proangiogener Faktoren in der Tumormikroumgebung mithilfe von Tyrosinkinase-Inhibitoren umzukehren, die in die VEGF-Signalübertragung eingreifen, um die Antitumorwirksamkeit von PD-1/L1-Inhibitoren zu erhöhen.
| 14. Schlussfolgerungen |
Die Therapielandschaft für fortgeschrittenes Melanom hat in den letzten Jahrzehnten eine deutliche Erweiterung erfahren. Trotz der Fortschritte in der Immuntherapie und bei zielgerichteten Therapien, die das Paradigma der Melanombehandlung revolutioniert haben, besteht ein anhaltender Bedarf an der Entwicklung neuartiger Therapien, insbesondere für Patienten mit fortgeschrittener Erkrankung oder für Patienten, die keine guten Kandidaten für systembasierte Therapien sind. immunologisch.
Die Identifizierung von Treibermutationen für die rationale Gestaltung neuer zielgerichteter Therapien wird von entscheidender Bedeutung sein, um die klinischen Ergebnisse weiter zu optimieren und die schwierige Heilung von Melanomen zu erreichen.
















