| 1. Introduzione |
I melanociti provengono dai progenitori della cresta neurale durante lo sviluppo embrionale e sono cellule pigmentate che producono melanina come risposta fotoprotettiva. Sebbene si trovino più comunemente nella pelle e nei capelli, i melanociti si trovano anche sulle superfici della mucosa e nel tratto uveale dell’occhio. La proliferazione clonale dei melanociti in queste rispettive regioni anatomiche dà origine a melanomi cutanei, della mucosa e uveali.
I fattori di rischio più importanti per i melanomi cutanei comprendono l’esposizione cronica ai raggi ultravioletti (UV) negli anziani e le scottature solari durante l’adolescenza e l’infanzia; ciò è supportato dalle sostituzioni nucleotidiche C> T correlate agli UV che predominano nella genetica dei melanomi cutanei. A livello molecolare, questa transizione maligna dai melanociti al melanoma è caratterizzata e apparentemente dipende dall’attivazione costitutiva della via RAS-RAF-MAPK/ERK, che regola la proliferazione cellulare, l’invasione, l’angiogenesi e la metastasi.
L’identificazione di mutazioni driver, come BRAFv600E/K, lungo questo percorso ha portato allo sviluppo di una terapia mirata con doppia inibizione di BRAF e MEK, che ha contribuito a un notevole miglioramento della sopravvivenza globale dei pazienti con melanoma. BRAF V600 avanzato ( Figura 1 ).
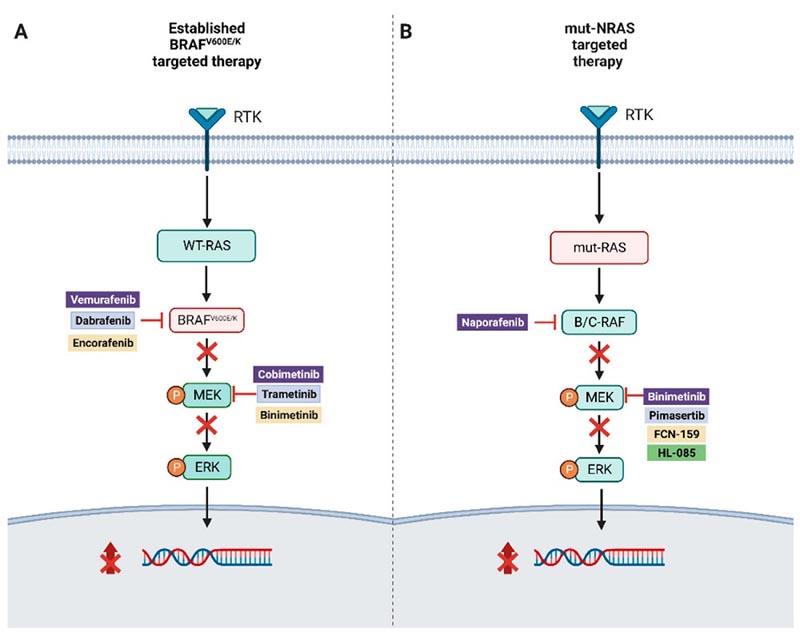
Figura 1.
( A ) Illustrazione della terapia mirata combinata nel melanoma con mutazione BRAFv600E/K.
( B ) Approcci terapeutici mirati per il melanoma NRAS-mutato.
Il panorama terapeutico per il melanoma ha fatto molta strada dai tempi in cui la prognosi per i pazienti con melanoma metastatico avanzato veniva misurata in mesi con dacarbazina e interleuchina-2 come uniche opzioni terapeutiche approvate dalla FDA. L’emergere dell’immunoterapia basata sui checkpoint immunitari come trattamento di prima linea ha cambiato significativamente i risultati. In questa recensione, gli autori evidenziano i recenti progressi nelle terapie mirate per il melanoma.
| 2. Mutazioni RAF, tramite MAPK |
Nel melanoma, i bersagli molecolari si trovano in gran parte all’interno della via di segnalazione MAPK, che appare fondamentale per la progressione del melanoma. Il percorso regola un’ampia gamma di attività cellulari, tra cui la proliferazione cellulare, la sopravvivenza, l’angiogenesi e la migrazione. La famiglia delle proteine RAF è composta da tre enzimi: ARAF, BRAF e CRAF (RAF-1). Le mutazioni sono presenti in circa l’8% dei tumori umani, con mutazioni somatiche che attivano BRAF nel 40-66% dei melanomi.
| 3. Resistenza al mutante BRAF |
La resistenza acquisita con recidiva clinica è quasi uniforme in tutti i pazienti trattati con la combinazione inibitore BRAF/MEK. Ciò è in parte dovuto a numerosi meccanismi di resistenza ai farmaci, che rendono difficile la prevenzione o il trattamento efficace.
| 4. Inibitori Pan-RAF |
Gli inibitori Pan-RAF sono stati sviluppati come approccio alternativo per prevenire o superare la resistenza e l’attivazione paradossa di specifici inibitori BRAF nei pazienti con mutazione BRAF-WT e NRAS, nonché nel sottogruppo di pazienti con mutazione BRAF V600E con resistenza. acquisita.
Poiché i primi studi hanno mostrato un’efficacia clinica limitata della monoterapia pan-RAF, i meccanismi di resistenza sono stati chiariti utilizzando cellule di melanoma che sono state trattate e che alla fine hanno sviluppato resistenza a belvarafenib, un inibitore pan-RAF. In vitro, è stato scoperto che i cloni resistenti a belvarafenib presentano una riattivazione della via MAPK attraverso mutazioni in ARAF che portano alla dimerizzazione e all’attività chinasica. In vivo, è stato riscontrato che anche il ctDNA ottenuto da pazienti con malattia progressiva dopo il trattamento con belvarafenib presentava mutazioni ARAF.
| 5. NRAS |
NRAS è una delle tre proteine della famiglia delle proteine RAS, che sono nella loro forma attiva quando legate al GTP e nella loro forma inattiva quando legate al GDP. Segnali della proteina RAS attivata attraverso la cascata della MAP chinasi per promuovere attività proliferative e antiapoptotiche. NRAS è la seconda mutazione driver più comune nel melanoma cutaneo, seconda solo a BRAF, e si riscontra nel 25-30% dei casi. Queste mutazioni si verificano frequentemente nell’esone 2, portando ad una sostituzione AA in posizione 61 (glutammina in arginina, lisina o istidina).32]. Le mutazioni oncogene più comuni nel RAS interferiscono con il ritorno del RAS allo stato inattivo legato al GDP, che è catalizzato dalle proteine che attivano la GTPasi.
I pazienti con mutazione NRAS con melanoma avanzato alla diagnosi hanno una sopravvivenza globale significativamente più breve (15,5 mesi contro 23,5 mesi). Nonostante la sua prevalenza e importanza nel melanoma, storicamente la RAS non si è dimostrata suscettibile di trattamento diretto a causa della mancanza di un trattamento facilmente farmacologico. I farmaci competitivi con il GTP sono limitati dall’affinità estremamente elevata di RAS per il GTP e dalle elevate concentrazioni intracellulari di GTP.
| 6. ERK |
ERK, un effettore a valle della via MAPK, catalizza la fosforilazione dei fattori di trascrizione nucleare una volta che è nel suo stato attivo. La segnalazione di ERK nel melanoma diventa indipendente dai meccanismi di feedback a causa delle mutazioni in BRAF e NRAS. Inoltre, la segnalazione di ERK viene mantenuta senza iperattivazione e successivo arresto o morte del ciclo cellulare a causa della regolazione del feedback intrinseco attraverso la trascrizione DUSP. La segnalazione di ERK viene ripristinata nei pazienti che acquisiscono resistenza all’inibizione di RAF e MEK, generando interesse nel prendere di mira direttamente ERK per affrontare la resistenza.
| 7. Mutazioni BRAF atipiche |
I melanomi con mutazione BRAF atipica comprendono un’alterazione genetica diversa e sono spesso suddivisi in mutanti V600 e non V600. Ciascuna mutazione è classificata nelle classi I, II o III in base al suo meccanismo di segnalazione e all’attività chinasica, portando a diversi gradi di deregolamentazione molecolare. Le mutazioni rare, BRAF V600 inclusa V600R/D/M/L, sono monomeri che attivano la chinasi tipicamente riscontrati nei pazienti maschi più anziani con una storia di danno solare cronico. I mutanti non V600 possono essere classificati come classe II (ad esempio, L597P/Q/R/S, K601E, G469R/S/A) o III (G596R, D594Y/N/G/E, D287Y) a seconda della formazione di dimeri per attivare le chinasi RAF o gli eterodimeri che alterano completamente l’attività della chinasi, con conseguente attivazione paradossale della segnalazione ERK, rispettivamente.
Tipicamente, i tumori di classe II e III hanno un decorso clinico più aggressivo e sono associati a una prognosi peggiore. Le mutazioni atipiche di BRAF sono più comunemente osservate nel melanoma della mucosa.
| 8. Inibizione di MEK CDK4/6 + |
Il 50% dei melanomi mutanti NRAS presentano aberrazioni genetiche nei geni associati al ciclo cellulare, fornendo una motivazione per combinare gli inibitori MEK con gli inibitori CDK4/6. Gli inibitori CDK4/6 causano l’arresto del ciclo cellulare impedendo al complesso CDK4/6-ciclina D1 di fosforilare la proteina del retinoblastoma. Uno studio preclinico utilizzando linee cellulari di melanoma umano mutante NRAS ha rivelato effetti sinergici sia sull’apoptosi che sull’arresto del ciclo cellulare con la corrispondente regressione del tumore. È attualmente in corso uno studio di Fase II che valuta l’efficacia dell’inibitore pan-RAF naporafenib combinato con ribociclib in pazienti con melanoma metastatico o non resecabile con mutazione NRAS.
| 9 . SHP2 |
La proteina tirosina fosfatasi 2, o SHP2, ha recentemente costituito la base per nuovi approcci terapeutici mirati. SHP2 funziona come una proteina tirosina fosfatasi coinvolta nell’attivazione di diverse vie di segnalazione, tra cui RAS/Raf/MAPK, PI3K/AKT, JAK/STAT e PD-1/PD-L1. Di conseguenza, la modulazione dell’attività SHP2 può influenzare la sopravvivenza cellulare e le vie di regolazione immunitaria.
| 10. Autofagia |
I melanomi che hanno acquisito resistenza all’inibizione di BRAF più MEK sono spesso caratterizzati da una malattia rapidamente progressiva. Uno dei meccanismi di resistenza che è stato identificato è l’autofagia, un processo cellulare adattivo in cui proteine anormali, organelli danneggiati e agenti patogeni vengono scomposti attraverso la degradazione lisosomiale per riciclare i componenti cellulari in precursori molecolari ed energia per facilitare l’autorinnovamento.
Nello specifico, l’inibizione di MEK1/2 aumenta il flusso autofagico attivando l’asse di segnalazione LKB1-AMPK-ULK1 nelle cellule tumorali guidate da RAS. Pertanto, l’autofagia è diventata un obiettivo razionale per superare la resistenza BRAF/MEK.
| 11 . Bersagli epigenetici |
EZH2 codifica una subunità catalitica del complesso repressivo Polycomb 2 (PRC2), che facilita la trimetilazione dell’istone H3 lisina 27. PRC2 svolge un ruolo chiave nella regolazione epigenica promuovendo la compattazione della cromatina. EZH2 è altamente espresso nel melanoma umano primario e metastatico ed è considerato necessario per la melanogenesi, la proliferazione e le metastasi; la sua espressione è associata ad una prognosi peggiore. Mutazioni puntiformi di EZH2 determinano un guadagno di funzione nel 5% dei melanomi e si trovano spesso in coesistenza con attivatori BRAF che possono indicare un sinergismo oncogenico.
| 12. BAP1 e HDAC |
La proteina 1 associata a BRCA1 (BAP1) è un gene soppressore del tumore che è frequentemente mutato nei melanomi uveali metastatici nelle fasi avanzate della melanomagenesi. La mutazione produce una perdita della funzione genetica e spinge le cellule a dedifferenziarsi e ad acquisire proprietà simili a steli con maggiore capacità di autoreplicazione. Le alterazioni nelle regolazioni epigenetiche contribuiscono a questo fenotipo, come dimostrato dal ripristino della differenziazione dei melanociti quando le cellule di melanoma uveale con mutazioni BAP1 vengono trattate con inibitori dell’istone deacetilasi (HDAC). Tuttavia, l’efficacia clinica degli inibitori dell’HDAC non è stata stabilita.
| 13. Immunoterapia potenziata |
L’avvento dell’immunoterapia ha rappresentato il progresso più significativo nella cura dei pazienti con melanoma avanzato rispetto agli sforzi iniziali con la terapia sistemica molti anni fa. Sebbene sia stato segnalato che la sopravvivenza mediana è pari a 72,1 mesi nei pazienti trattati con la combinazione ipilimumab/nivolumab, questo approccio può essere limitato da eventi avversi immunologici significativi correlati al trattamento e dallo sviluppo di resistenza.
Sono stati intrapresi diversi approcci innovativi per combinare l’immunoterapia con agenti terapeutici mirati per superare la resistenza e migliorare i risultati. Un approccio ben consolidato è stato quello di invertire l’effetto immunosoppressivo dei fattori proangiogenici nel microambiente tumorale utilizzando inibitori della tirosina chinasi che interferiscono con la segnalazione VEGF per aumentare l’efficacia antitumorale degli inibitori PD-1/L1.
| 14.Conclusioni |
Il panorama terapeutico per il melanoma avanzato ha registrato una significativa espansione negli ultimi decenni. Nonostante i progressi nell’immunoterapia e nelle terapie mirate che hanno rivoluzionato il paradigma del trattamento del melanoma, esiste una necessità persistente di sviluppare nuove terapie, in particolare per i pazienti che hanno progredito o per quei pazienti che non sono buoni candidati per le terapie sistemiche. immunologico.
L’identificazione di mutazioni determinanti per la progettazione razionale di nuove terapie mirate sarà di vitale importanza per continuare a ottimizzare i risultati clinici e raggiungere la difficile cura del melanoma.
















