| 1. Introduction |
Les mélanocytes proviennent des progéniteurs de la crête neurale au cours du développement embryonnaire et sont des cellules pigmentées qui produisent de la mélanine comme réponse photoprotectrice. Bien que l’on trouve le plus souvent dans la peau et les cheveux, les mélanocytes se trouvent également sur les surfaces muqueuses et dans le tractus uvéal de l’œil. La prolifération clonale des mélanocytes dans ces régions anatomiques respectives donne lieu à des mélanomes cutanés, muqueux et uvéaux.
Les facteurs de risque les plus importants de mélanomes cutanés comprennent l’exposition chronique aux rayons ultraviolets (UV) chez les personnes âgées et les coups de soleil intenses pendant l’adolescence et l’enfance ; ceci est corroboré par les substitutions de nucléotides C > T liées aux UV qui prédominent dans la génétique des mélanomes cutanés. Au niveau moléculaire, cette transition maligne des mélanocytes au mélanome est caractérisée et dépend apparemment de l’activation constitutive de la voie RAS-RAF-MAPK/ERK, qui régule la prolifération cellulaire, l’invasion, l’angiogenèse et les métastases.
L’identification de mutations motrices, telles que BRAFv600E/K, le long de cette voie a conduit au développement d’une thérapie ciblée avec une double inhibition de BRAF et de MEK, qui a contribué à une amélioration notable de la survie globale des patients atteints de mélanome. BRAF V600 avancé ( Figure 1 ).
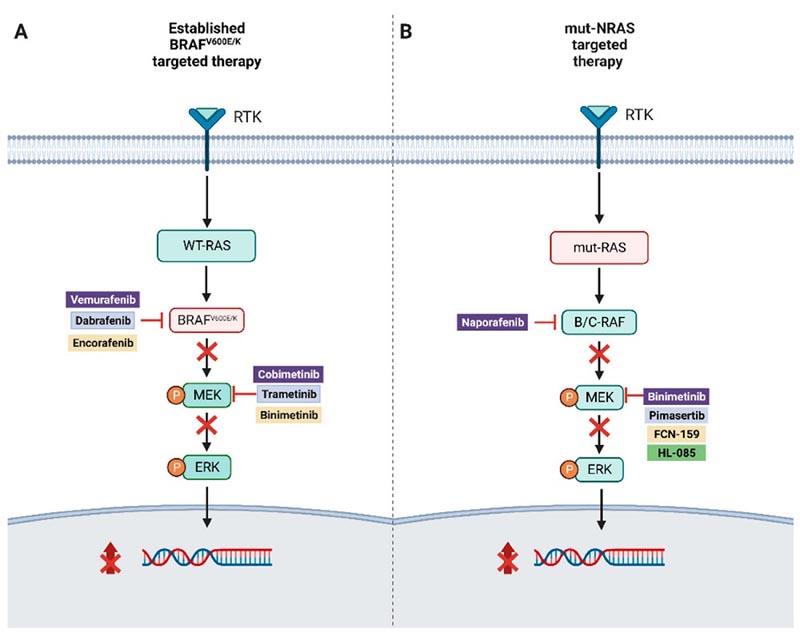
Figure 1.
( UNE ) Illustration d’une thérapie ciblée combinée dans le mélanome muté BRAFv600E/K.
( B ) Approches thérapeutiques ciblées pour le mélanome muté par NRAS.
Le paysage thérapeutique du mélanome a parcouru un long chemin depuis l’époque où le pronostic des patients atteints de mélanome métastatique avancé était mesuré en mois avec la dacarbazine et l’interleukine-2 comme seules options de traitement approuvées par la FDA. L’émergence de l’immunothérapie basée sur les points de contrôle immunitaire comme traitement de première intention a considérablement modifié les résultats. Dans cette revue, les auteurs mettent en évidence les progrès récents dans les thérapies ciblées contre le mélanome.
| 2. Mutations RAF, via MAPK |
Dans le mélanome, les cibles moléculaires se situent en grande partie dans la voie de signalisation MAPK, qui semble essentielle à la progression du mélanome. La voie régule un large éventail d’activités cellulaires, notamment la prolifération cellulaire, la survie, l’angiogenèse et la migration. La famille des protéines RAF comprend trois enzymes : ARAF, BRAF et CRAF (RAF-1). Des mutations sont présentes dans environ 8 % des tumeurs humaines, avec des mutations somatiques activant BRAF dans 40 à 66 % des mélanomes.
| 3. Résistance aux mutants BRAF |
La résistance acquise avec rechute clinique est presque uniforme chez tous les patients traités par l’association inhibiteur de BRAF/MEK. Cela est dû en partie aux nombreux mécanismes de résistance aux médicaments, qui rendent difficile sa prévention ou son traitement efficace.
| 4. Inhibiteurs Pan-RAF |
Les inhibiteurs de Pan-RAF ont été développés comme approche alternative pour prévenir ou surmonter la résistance et l’activation paradoxale d’inhibiteurs spécifiques de BRAF chez les patients mutés BRAF-WT et NRAS, ainsi que dans le sous-ensemble de patients mutés BRAF V600E présentant une résistance. acquis.
Étant donné que les premières études ont montré une efficacité clinique limitée de la monothérapie pan-RAF, les mécanismes de résistance ont été élucidés à l’aide de cellules de mélanome qui ont été traitées et ont finalement développé une résistance au belvarafénib, un inhibiteur du pan-RAF. In vitro, il a été constaté que les clones résistants au belvarafénib présentaient une réactivation de la voie MAPK grâce à des mutations dans l’ARAF conduisant à une dimérisation et à une activité kinase. In vivo, l’ADNc obtenu de patients présentant une maladie évolutive après un traitement par le belvarafénib s’est également révélé présenter des mutations ARAF.
| 5. NRAS |
NRAS est l’une des trois protéines de la famille des protéines RAS, qui sont sous leur forme active lorsqu’elles sont liées au GTP et sous leur forme inactive lorsqu’elles sont liées au GDP. La protéine RAS activée signale via la cascade MAP kinase pour favoriser les activités prolifératives et anti-apoptotiques. NRAS est la deuxième mutation motrice la plus courante dans le mélanome cutané, juste derrière BRAF, et est retrouvée dans 25 à 30 % des cas. Ces mutations se produisent fréquemment dans l’exon 2, conduisant à une substitution AA en position 61 (glutamine en arginine, lysine ou histidine).32]. Les mutations oncogènes les plus courantes du RAS interfèrent avec le retour du RAS à un état inactif lié au GDP, catalysé par les protéines activant la GTPase.
Les patients mutés par NRAS et atteints d’un mélanome avancé au moment du diagnostic ont une survie globale significativement plus courte (15,5 mois contre 23,5 mois). Malgré sa prévalence et son importance dans le mélanome, le RAS ne s’est historiquement pas révélé susceptible d’être traité directement en raison de l’absence de traitement pharmacologique simple. Les médicaments compétitifs avec le GTP sont limités par l’affinité extrêmement élevée du RAS pour le GTP et par les concentrations intracellulaires élevées de GTP.
| 6. ERK |
ERK, un effecteur en aval de la voie MAPK, catalyse la phosphorylation des facteurs de transcription nucléaires une fois qu’il est dans son état actif. La signalisation ERK dans le mélanome devient indépendante des mécanismes de rétroaction dus aux mutations de BRAF et NRAS. De plus, la signalisation ERK est maintenue sans hyperactivation ni arrêt ultérieur du cycle cellulaire ni mort en raison de la régulation intrinsèque par rétroaction via la transcription DUSP. La signalisation ERK est restaurée chez les patients qui acquièrent une résistance à l’inhibition de la RAF et de la MEK, ce qui suscite l’intérêt de cibler directement l’ERK pour lutter contre la résistance.
| 7. Mutations atypiques de BRAF |
Les mélanomes avec mutation BRAF atypique englobent une altération génétique diversifiée et sont souvent subdivisés en mutants V600 et non-V600. Chaque mutation est classée en classes I, II ou III en fonction de son mécanisme de signalisation et de son activité kinase, conduisant à différents degrés de dérégulation moléculaire. Les mutations rares, BRAF V600, y compris V600R/D/M/L, sont des monomères activant des kinases que l’on retrouve typiquement chez les patients masculins plus âgés ayant des antécédents de dommages chroniques causés par le soleil. Les mutants non V600 peuvent être classés en classe II (par exemple, L597P/Q/R/S, K601E, G469R/S/A) ou III (G596R, D594Y/N/G/E, D287Y) en fonction de la formation de dimères. pour activer les kinases RAF ou les hétérodimères qui modifient complètement l’activité des kinases, entraînant respectivement une activation paradoxale de la signalisation ERK.
En règle générale, les tumeurs de classe II et III ont une évolution clinique plus agressive et sont associées à un pronostic plus sombre. Les mutations atypiques de BRAF sont le plus souvent observées dans le mélanome muqueux.
| 8. Inhibition de MEK CDK4/6 + |
Cinquante pour cent des mélanomes mutants NRAS présentent des aberrations génétiques dans les gènes associés au cycle cellulaire, ce qui justifie la combinaison des inhibiteurs de MEK avec les inhibiteurs de CDK4/6. Les inhibiteurs de CDK4/6 provoquent un arrêt du cycle cellulaire en empêchant le complexe CDK4/6-cycline D1 de phosphoryler la protéine du rétinoblastome. Une étude préclinique utilisant des lignées cellulaires de mélanome humain mutant NRAS a révélé des effets synergiques sur l’apoptose et l’arrêt du cycle cellulaire avec régression tumorale correspondante. Un essai de phase II évaluant l’efficacité du naporafenib, un inhibiteur pan-RAF, associé au ribociclib chez des patients atteints d’un mélanome métastatique ou non résécable muté par NRAS est actuellement en cours.
| 9 . SHP2 |
La protéine tyrosine phosphatase 2, ou SHP2, a récemment constitué la base de nouvelles approches thérapeutiques ciblées. SHP2 fonctionne comme une protéine tyrosine phosphatase impliquée dans l’activation de plusieurs voies de signalisation, notamment RAS/Raf/MAPK, PI3K/AKT, JAK/STAT et PD-1/PD-L1. Par conséquent, la modulation de l’activité de SHP2 peut affecter la survie cellulaire et les voies de régulation immunitaire.
| 10. Autophagie |
Les mélanomes qui ont acquis une résistance à l’inhibition de BRAF et de MEK sont souvent caractérisés par une maladie à progression rapide. L’un des mécanismes de résistance identifiés est l’autophagie, un processus cellulaire adaptatif dans lequel les protéines anormales, les organites endommagés et les agents pathogènes sont décomposés par dégradation lysosomale afin de recycler les composants cellulaires en précurseurs moléculaires et en énergie pour faciliter l’auto-renouvellement.
Plus précisément, l’inhibition de MEK1/2 augmente le flux autophagique en activant l’axe de signalisation LKB1-AMPK-ULK1 dans les cellules cancéreuses pilotées par RAS. Par conséquent, l’autophagie est devenue une cible rationnelle pour vaincre la résistance BRAF/MEK.
| 11 . Cibles épigénétiques |
EZH2 code pour une sous-unité catalytique du complexe répressif Polycomb 2 (PRC2), qui facilite la triméthylation de l’histone H3 lysine 27. PRC2 joue un rôle clé dans la régulation épigénique en favorisant le compactage de la chromatine. EZH2 est fortement exprimé dans les mélanomes humains primaires et métastatiques et est considéré comme nécessaire à la mélanogenèse, à la prolifération et aux métastases ; son expression est associée à un pire pronostic. Les mutations ponctuelles d’EZH2 entraînent un gain de fonction dans 5 % des mélanomes et se retrouvent souvent en coexistence avec des activateurs de BRAF pouvant indiquer une synergie oncogène.
| 12. BAP1 et HDAC |
La protéine 1 associée à BRCA1 (BAP1) est un gène suppresseur de tumeur qui est fréquemment muté dans les mélanomes uvéaux métastatiques aux derniers stades de la mélanomagenèse. La mutation produit une perte de fonction des gènes et pousse les cellules à se dédifférencier et à acquérir des propriétés semblables à celles d’une tige avec une plus grande capacité d’auto-réplication. Les altérations des régulations épigénétiques contribuent à ce phénotype, comme le démontre la restauration de la différenciation des mélanocytes lorsque les cellules de mélanome uvéal présentant des mutations BAP1 sont traitées avec des inhibiteurs de l’histone désacétylase (HDAC). Cependant, l’efficacité clinique des inhibiteurs d’HDAC n’a pas été établie.
| 13. Immunothérapie améliorée |
L’avènement de l’immunothérapie a représenté l’avancée la plus significative dans la prise en charge des patients atteints de mélanome avancé depuis les premiers efforts de thérapie systémique il y a de nombreuses années. Bien que la survie médiane ait été rapportée jusqu’à 72,1 mois chez les patients traités par l’association ipilimumab/nivolumab, cette approche peut être limitée par des événements indésirables immunologiques importants liés au traitement et par le développement d’une résistance.
Plusieurs nouvelles approches ont été entreprises pour combiner l’immunothérapie avec des agents thérapeutiques ciblés afin de vaincre la résistance et d’améliorer les résultats. Une approche bien établie consiste à inverser l’effet immunosuppresseur des facteurs proangiogéniques dans le microenvironnement tumoral à l’aide d’inhibiteurs de tyrosine kinase qui interfèrent avec la signalisation du VEGF pour augmenter l’efficacité antitumorale des inhibiteurs de PD-1/L1.
| 14.Conclusions |
Le paysage thérapeutique du mélanome avancé a connu une expansion significative au cours des dernières décennies. Malgré les progrès de l’immunothérapie et des thérapies ciblées qui ont révolutionné le paradigme du traitement du mélanome, il existe un besoin persistant de développer de nouvelles thérapies, en particulier pour les patients qui ont progressé ou pour les patients qui ne sont pas de bons candidats aux thérapies systémiques. immunologique.
L’identification de mutations déterminantes pour la conception rationnelle de nouvelles thérapies ciblées sera d’une importance vitale pour continuer à optimiser les résultats cliniques et parvenir à la difficile guérison du mélanome.
















