Zusammenfassung Manche Menschen können nach einer ersten schweren Infektion mit dem akuten respiratorischen Syndrom Coronavirus 2 (SARS-CoV-2) viele Monate lang anhaltende und schwächende Symptome ertragen. Allerdings sind die Faktoren, die diesen Gesundheitsproblemen, die als Long-Covid bezeichnet werden, zugrunde liegen, nicht genau bekannt. Durch den Vergleich des Blutes von Patienten mit bestätigter SARS-CoV-2-Infektion mit dem von nicht infizierten Kontrollpersonen konnten Cervia-Hasler et al. fanden heraus, dass bei Patienten mit langem COVID Veränderungen in den Blutserumproteinen auftraten, die auf eine Aktivierung der Komplementkaskade des Immunsystems, eine beeinträchtigte Gerinnung und eine Gewebeschädigung hindeuteten . Auf zellulärer Ebene war es mit Aggregaten aus Monozyten und Blutplättchen verbunden . Diese Ergebnisse stellen eine Quelle potenzieller Biomarker für die Diagnose dar und können als Grundlage für Behandlungsanweisungen dienen. |
Einführung
Eine akute schwere Infektion mit dem akuten respiratorischen Syndrom Coronavirus 2 (SARS-CoV-2) verursacht verschiedene klinische Phänotypen, die von asymptomatischem bis lebensbedrohlichem COVID-19 reichen. Etwa 5 % aller Infizierten erholen sich nicht von der akuten Erkrankung, sondern entwickeln Langzeitkomplikationen, sogenannte Long-Covid. Aktuelle Hypothesen zu den Faktoren, die zu einer langen Covid-Erkrankung beitragen, umfassen Gewebeschäden, Virusreservoirs, Autoimmunität und anhaltende Entzündungen. Derzeit gibt es keine diagnostischen Tests oder therapeutischen Lösungen für betroffene Patienten.
Methodik
Wir haben 39 gesunde Kontrollpersonen und 113 COVID-19-Patienten bis zu einem Jahr nach der ersten Bestätigung einer akuten SARS-CoV-2-Infektion beobachtet, um Biomarker zu identifizieren, die mit langem Covid in Zusammenhang stehen. Im 6-monatigen Follow-up hatten 40 Patienten Symptome einer langen Covid-Erkrankung.
Wiederholte klinische Untersuchungen wurden mit Blutentnahmen kombiniert, was zu insgesamt 268 Längsschnittblutproben führte. Mithilfe der Proteomik messen wir >6500 Proteine im Serum . Die wichtigsten Biomarkerkandidaten wurden mithilfe von Computertools identifiziert und experimentell bewertet.
Ergebnisse
Long-Covid-Patienten zeigten während der akuten Erkrankung eine stärkere Komplementaktivierung, die auch nach 6 Monaten anhielt. Das Komplementsystem ist Teil des angeborenen Immunsystems und trägt unter anderem durch den Angriff auf Krankheitserreger und geschädigte Zellen zur Immunität und Homöostase bei. Interessanterweise normalisierten sich die Blutkomplementspiegel bei Patienten mit langer Covid-19-Erkrankung, die sich vor der Nachbeobachtungszeit von 6 Monaten erholten.
Das Komplementsystem kann durch verschiedene Auslöser aktiviert werden, was zur Bildung des terminalen Komplementkomplexes (TCC) führt, der aus den Komplementkomponenten C5b-9 besteht. Diese Komplexe können sich in Zellmembranen integrieren und eine Zellaktivierung oder -lyse induzieren. Long-Covid-Patienten zeigten eine unausgewogene Bildung des terminalen Komplementkomplexes (TCC), gekennzeichnet durch einen Anstieg löslicher C5bC6-Komplexe und einen Rückgang der Mengen an C7-haltigen TCC-Formationen, die in Zellmembranen eingebaut werden können. Dies deutete darauf hin, dass bei Long-Covid-Patienten vermehrt CBT-Membranen eingesetzt wurden, was zu Gewebeschäden beitrug.
Folglich zeigten Long-Covid-Patienten erhöhte Marker für Gewebeschäden im Blut und eine thromboinflammatorische Signatur, die durch Marker für die Endothelaktivierung wie den von Willebrand-Faktor (vWF) und die Lyse roter Blutkörperchen gekennzeichnet ist. Niedrige Antithrombin-III-Spiegel bei Long-Covid-Patienten gingen mit Anzeichen einer verstärkten Spaltung durch Thrombin einher, einem Treiber der Bildung des terminalen Komplementkomplexes (TCC).
Darüber hinaus wiesen Patienten mit Long-Covid bei der 6-monatigen Nachuntersuchung Marker für die Aktivierung von Blutplättchen und erhöhte Monozyten-Blutplättchen-Aggregate auf, insbesondere in Fällen, in denen Long-Covid 12 Monate oder länger anhielt. Diese Patienten zeigten auch Anzeichen einer Antikörper-vermittelten Aktivierung des klassischen Komplementwegs, die mit erhöhten Anti-CMV- (Cytomegalievirus, auch bekannt als humanes Herpesvirus 5) und Anti-EBV-(Herpesvirus 5) Immunglobulin G (IgG)-Antikörpern einherging. Epstein-Barr).
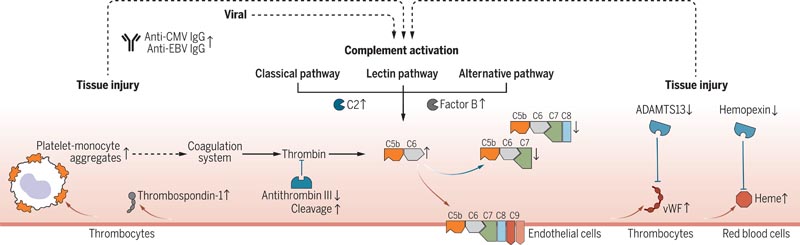
Abbildung : Pathomechanistisches Modell von Long Covid. Komplementvermitteltes Thromboinflammationsmodell, das einen Anstieg und Rückgang der Biomarker (Pfeile nach oben bzw. Pfeil nach unten) zeigt, gemessen bei der Nachbeobachtung nach 6 Monaten bei Patienten mit anhaltenden langen Covid-Symptomen im Vergleich zu genesenen COVID-19-Patienten. 19 und gesunde Kontrollpersonen. Die Messungen wurden mithilfe von Proteomik, spektraler Durchflusszytometrie, Einzelzell-Transkriptomik, Hochdurchsatz-Antikörpermessungen und gezielten Tests durchgeführt. Rote Pfeile markieren aktivierende Proteininteraktionen und blaue Pfeile markieren hemmende Proteininteraktionen. Gestrichelte Pfeile verbinden Veränderungen in verschiedenen biologischen Signalwegen.
Schlussfolgerungen Unsere Daten deuten darauf hin, dass aktives Long-Covid mit einer Blutproteinsignatur einhergeht, die durch eine erhöhte Komplementaktivierung und Thromboinflammation gekennzeichnet ist, einschließlich aktivierter Blutplättchen und Marker für die Lyse roter Blutkörperchen. Gewebeschäden können auch durch Komplement vermittelt werden und wiederum das Komplementsystem aktivieren. Darüber hinaus kann die Komplementaktivierung durch Antigen-Antikörper-Komplexe vorangetrieben werden, an denen Autoantikörper und Antikörper gegen Herpesviren beteiligt sind, sowie durch Störungen eines fehlregulierten Gerinnungssystems. Neben der Bereitstellung einer Grundlage für neue diagnostische Lösungen unterstützen wir mit unserer Arbeit die klinische Forschung zu Komplementmodulatoren für Patienten mit Long-Covid. |