Einführung
Präsentation eines Falles Ein 67-jähriger Mann mit Vorhofflimmern, das mit Edoxaban behandelt wurde und sich 4 Wochen vor der Konsultation zu verschlimmern begann, mit Atembeschwerden. Er ist Raucher und konsumiert 40 Packungen pro Jahr. Aufgrund seiner Arbeit als Bauunternehmer war er bereits Asbest ausgesetzt. Der Arzt verlangte eine Röntgenaufnahme des Brustkorbs, die einen einseitigen (rechten) Pleuraerguss mittlerer Größe zeigte. |
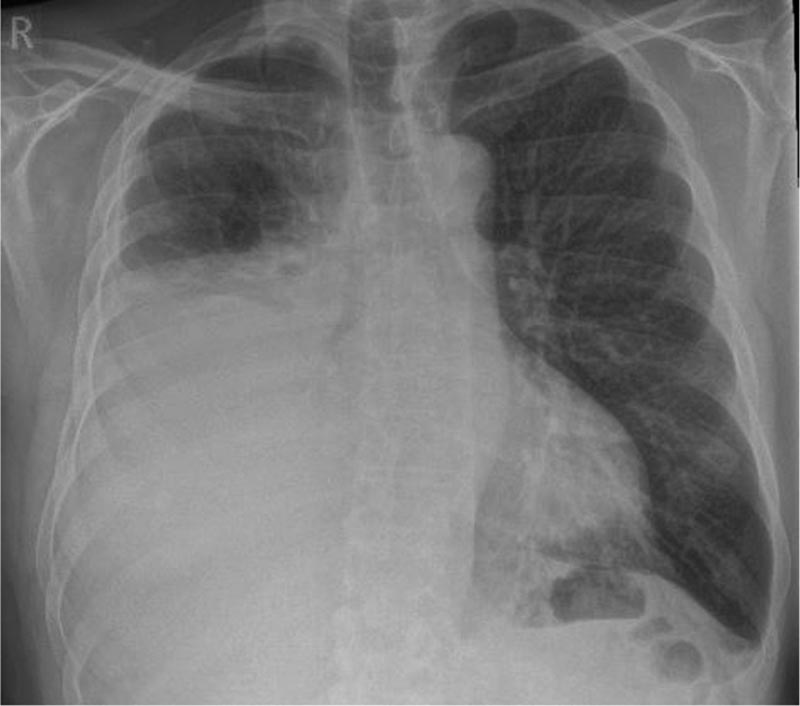
Abbildung 1: Erstes Röntgenbild des Brustkorbs
Was ist die Ursache für die Symptome dieses Patienten?
Bei einigen Patienten mit Pleuraerguss treten möglicherweise nur minimale Symptome auf, bei anderen kann es jedoch zu Kurzatmigkeit und eingeschränkter körperlicher Betätigung kommen. Dies kann mit einer normalen oder verringerten Sauerstoffsättigung verbunden sein.
Die Physiologie der mit einem Pleuraerguss einhergehenden Dyspnoe ist nicht genau geklärt, aber eine verringerte Beatmungskapazität und ein verringerter Gasaustausch sowie eine abnormale Bewegung der Atemmuskulatur mit verringerter Brustkorbausdehnung dürften dazu beitragen. und Schienung des Zwerchfells.
Was ist die Ursache eines Pleuraergusses?
Obwohl die Ätiologie des Pleuraergusses dieses Patienten unbekannt ist, lassen bestimmte Risikofaktoren (einschließlich Rauchen in der Vorgeschichte und Asbestexposition) die Autoren zunächst auf einen bösartigen Pleuraerguss schließen. Ipsilaterale Brustschmerzen können auf ein bösartiges Mesotheliom hinweisen.
Pleuraergüsse werden aufgrund ihrer biochemischen Eigenschaften in Exsudate und Transsudate eingeteilt, können aber auch auf Blut, Eiter und Chylus zurückzuführen sein.
| Häufige Ursachen für Pleuraexsudate und -transsudate | |
Exsudate Infektionen (bakterielle, Tuberkulose- und parasitäre Erkrankungen), bösartige Erkrankungen (Mesotheliom, Lungen- und Brustkrebs), Bindegewebserkrankungen (rheumatoide Arthritis), medikamenteninduzierte Entzündungszustände (z. B. Lungeninfarkt), Akute Pankreatitis Chylothorax |
Transsudate Herzinsuffizienz Leberzirrhose Chronisches Nierenversagen Hypoalbuminämie
|
Die Anwendung der Light-Kriterien kann bei der Diagnose eines exsudativen Ergusses hilfreich sein. Allerdings werden 25 % der Transsudate fälschlicherweise als Exsudate klassifiziert und daher kann es notwendig sein, den Serum-/Pleuraflüssigkeitsalbumingradienten zu berechnen, um Fehldiagnosen zu vermeiden.
Lichtkriterien für exsudative Ergüsse Exsudative Ergüsse können eine oder mehrere der folgenden Ursachen haben. > Pleuraflüssigkeitsprotein/Serumprotein > 0,5. > LDH in der Pleuraflüssigkeit / LDH im Serum > 0,6. > LDH der Pleuraflüssigkeit > 2/3 der Obergrenze des Serum-LDH |
| LDH: Milchsäuredehydrogenase |
Exsudative Ergüsse werden häufig durch Infektionen, bösartige Erkrankungen und entzündliche Erkrankungen verursacht, beispielsweise bei rheumatoider Arthritis. Die häufigsten bösartigen Pleuraergüsse werden durch Neoplasien der Lunge und der Brust verursacht und betreffen bis zu 15 % der Krebspatienten.
Transsudatergüsse, oft bilateral, werden normalerweise durch ein Ungleichgewicht zwischen onkotischem und hydrostatischem Druck verursacht und sind mit Herz-, Nieren- oder Leberversagen verbunden. Es wurde gezeigt, dass nichtmaligne Pleuraergüsse eine hohe jährliche Sterblichkeitsrate aufweisen. Bei bis zu 30 % der Pleuraergüsse wird eine multifaktorielle ätiologische Diagnose gestellt. Daher ist eine genaue ätiologische Diagnose unerlässlich, da diese die Wahl der weiteren Behandlung beeinflusst.
Eine Woche später suchte er einen Lungenarzt auf .
Welche Intervention ist am besten geeignet?
Bei Patienten mit Verdacht auf einen nicht diagnostizierten bösartigen Erguss kann eine Pleurapunktion durchgeführt werden, während die weitere Vorgehensweise geplant wird und wie der sinnvolle Eingriff aussehen wird, wenn die Pleuraflüssigkeit bösartige Zellen enthält.
Aufgrund der Blutungsgefahr wurde Edoxaban 48 Stunden vor dem Eingriff abgesetzt. Nach Aspiration von 1 Liter Pleuraflüssigkeit besserten sich die Symptome. Die Flüssigkeit wurde zur biochemischen (Proteine, Laktatdehydrogenase und Glucose), mikrobiologischen und zytologischen Analyse ins Labor geschickt.
Der Eingriff bei Pleuraergüssen kann zu diagnostischen und therapeutischen Zwecken durchgeführt werden. Wenn die Ursache der Verschüttung unklar ist, muss eine Entscheidung über die am besten geeignete Maßnahme getroffen werden, basierend auf:
- Die Symptome und/oder der klinische Zustand des Patienten.
- Die Ätiologie des Pleuraergusses (falls festgestellt)
- Falls weitere Studien notwendig sind.
Es ist zu beachten, dass es bei der Durchführung von Pleuraeingriffen zur Flüssigkeitsentfernung unbedingt erforderlich ist, einen sofortigen oder Echtzeit- Thoraxultraschall zu verwenden. Im Jahr 2008 warnte die WHO vor Todesfällen und schweren Schäden durch das Einlegen einer Thoraxdrainage.
Die British Thoracic Society (BTS) hat kürzlich Schulungsstandards für Thorax-Ultraschall für Ärzte veröffentlicht, die sich auch mit der Behandlung akuter Atemwegsprobleme und der Durchführung von Notfall-Ultraschalluntersuchungen des Thorax befassen.
Andererseits sind nicht dringende Eingriffe bei Vorliegen einer Koagulopathie kontraindiziert. Das BTS empfiehlt, Eingriffe bei gerinnungshemmenden Patienten zu vermeiden, bis der INR (International Normalised Ratio) <1,5 beträgt.
Direkte orale Antikoagulanzien sollten je nach Nierenfunktion und Blutungsrisiko für 24 bis 48 Stunden abgesetzt werden, während therapeutisches Heparin mit niedrigem Molekulargewicht ebenfalls für 24 Stunden abgesetzt werden sollte.
Diagnostische Thorakozentese
Bei den meisten Patienten ist die diagnostische Thorakozentese die geeignete Erstuntersuchung.
Es handelt sich um ein minimalinvasives Verfahren, das unter Ultraschallkontrolle durchgeführt wird und die Analyse der Pleuraflüssigkeit zu diagnostischen Zwecken ermöglicht. Bei malignen Pleuraergüssen weist die Pleuraflüssigkeitszytologie eine unterschiedliche diagnostische Sensitivität auf. Frühere BTS-Richtlinien gaben eine diagnostische Genauigkeit von 60 % an, eine aktuelle Studie ergab jedoch, dass die Sensitivität der Zytologie etwa 45 % bis 55 % beträgt.
Die diagnostische Sensitivität ist bei Vorliegen von Eierstock-, Brust- und Lungenkrebs (Adenokarzinom) höher, nämlich 95 %, 71 % bzw. 82 %. Bei malignen Mesotheliomen zeigten frühere Studien eine diagnostische Sensitivität zwischen 16 % und 73 %. Obwohl Arnold et al. kürzlich gezeigt haben, dass die Empfindlichkeit eher bei 6 % liegt.
Darüber hinaus empfehlen die BTS-Richtlinien, dass für die Diagnose ein Mindestvolumen von 20–40 ml Pleuraflüssigkeit erforderlich ist. Es wurde jedoch nachgewiesen, dass ein Mindestvolumen von 75 ml die diagnostische Empfindlichkeit erhöht.
Selbst wenn eine Diagnose gestellt wird, reicht das Material möglicherweise nicht immer für molekulare Marker/ Treibermutationen aus, was bei der Entscheidungsfindung für eine Immuntherapie oder eine gezielte molekulare Therapie hilfreich sein wird.
Therapeutische Thorakozentese
Therapeutische Thorakozentese unter Ultraschall
Die Richtlinie ermöglicht die Analyse der Pleuraflüssigkeit zur Unterstützung der Diagnose sowie die Entnahme einer größeren Menge Pleuraflüssigkeit zur Linderung der Symptome. Der Eingriff vermeidet das Einlegen einer Thoraxdrainage und kann daher ambulant durchgeführt werden, um einen Krankenhausaufenthalt zu vermeiden. Wenn die Pleuraflüssigkeitszytologie nicht diagnostisch ist, erfordert die verbleibende Pleuraflüssigkeit einen größeren Eingriff, einschließlich einer bildgesteuerten Pleurabiopsie oder einer Thorakoskopie mit örtlicher Betäubung.
Interkostale Thoraxdrainage
Die unter Ultraschallkontrolle durchgeführte interkostale Thoraxdrainage (ITD) ermöglicht die Analyse der Pleuraflüssigkeit, die vollständige Drainage des Pleuraergusses und bei Bedarf die Verabreichung intrapleuraler Wirkstoffe.
Pleurodese wird üblicherweise durch die Verabreichung einer Talkumsuspension durch die interkostale Thoraxdrainage induziert, um das Wiederauftreten eines wahrscheinlichen oder bestätigten malignen Pleuraergusses zu verhindern. Die Pleurodese mit Talkaufschlämmung weist eine Ausfallrate von 24 % auf. Diese Option kann für symptomatische Patienten mit großvolumigen Pleuraergüssen geeignet sein, die nicht gehfähig oder gebrechlich sind, bei denen andere invasive Tests möglicherweise nicht geeignet sind oder wenn die Ätiologie des Ergusses bekannt ist.
Die BTS-Leitlinie empfiehlt Vorsicht, wenn mehr als 1,5 l Pleuraflüssigkeit bei einer einzigen Gelegenheit entnommen werden, da das Risiko besteht, dass sich ein erneutes Lungenödem entwickelt, ein Zustand, der Husten, Brustschmerzen und sogar Herz-Kreislauf-Instabilität und -Kollaps verursachen kann. .
Eine weitere Warnung unterstreicht die Notwendigkeit, eine kontrollierte Drainage zu gewährleisten, um diese mögliche Komplikation zu vermeiden. Ärzte sollten beachten, dass Eingriffe bei Pleuraerguss trotz der Verwendung von Thoraxultraschall nach Stunden vermieden werden sollten, es sei denn, es handelt sich um einen Notfall, um Fehler und Komplikationen zu minimieren.
Eine Röntgenaufnahme des Brustkorbs nach einer therapeutischen Thorakozentese ergab die Bildung eines Hydropneumothorax, was die Möglichkeit einer nicht erweiterbaren Lunge erhöht. Es wurde eine Flüssigkeitsanalyse des exsudativen Pleuraergusses angefordert (Protein 40 g/l und LDH 620 IU).
Die Zytologie ergab einen Lymphozytenerguss ohne bösartige Zellen. Die Computertomographie (CT) des Brustkorbs zeigte einen parietalen Pleurakortex, der überwiegend den rechten Unterlappen umfasste, was wahrscheinlich zu einer nicht dehnbaren Lunge führte.
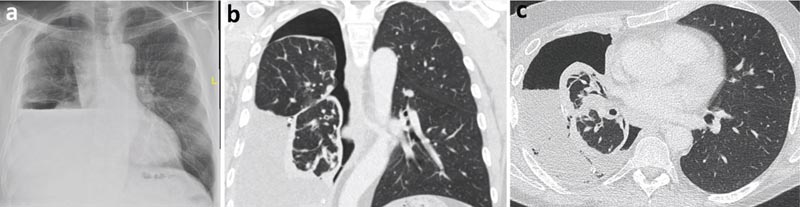
Abbildung 2
a) Röntgenaufnahme des Brustkorbs nach Thorakozentese mit Hydropneumothorax (Luft und Flüssigkeit in der Pleurahöhle).
b) Thorax-CT, koronale Ansicht.
c) Thorax-CT, axiale Ansicht.
Welcher nächste Eingriff ist am besten geeignet?
Da die Pleuraflüssigkeitszytologie nicht diagnostisch war, wurde der Patient unter örtlicher Betäubung und mäßiger Sedierung (TAS) einer Thorakoskopie unterzogen, die auch als medizinische Thorakoskopie oder Pleuroskopie bezeichnet wird. Dabei handelt es sich um einen von Lungenärzten durchgeführten medizinischen Eingriff, der eine innere Untersuchung, eine Biopsie und/oder die Verabreichung therapeutischer Wirkstoffe in die Pleurahöhle umfasst.
Seine Hauptindikation ist die Untersuchung exsudativer Ergüsse unbekannter Ätiologie, insbesondere wenn kein Pleuraziel für die Entnahme der CT-gesteuerten Biopsieprobe und Pleurodese vorhanden ist. Es eignet sich auch für die Diagnose von Pleuratuberkulose in Kombination mit Probenentnahmen für Kultur und Histologie, wobei die Sensitivität je nach Prävalenz bis zu 100 % beträgt.
Die Wirksamkeit der TAS in der Malignitätsdiagnostik ist ebenso hoch wie die der Biopsie in der videoassistierten thorakoskopischen Chirurgie (VATS). Diese Biopsie wird im Allgemeinen unter Vollnarkose und Ein-Lungen-Beatmung durchgeführt. TAS kann auch für therapeutische Indikationen eingesetzt werden. Eine Pleurodese mit Talkumpuder kann angewendet werden, wenn die Pleura bei der direkten Untersuchung abnormal erscheint. Es ist ebenso wirksam wie Talkumbrei, um bei Patienten mit Lungen- oder Brustkrebs eine Pleurodese wirksamer zu erreichen.
TAS kann auch bei Pleurainfektionen hilfreich sein, da es die Durchtrennung von Septen und Verwachsungen ermöglicht und dabei hilft, die Thoraxdrainage genauer zu platzieren.
TAS kann mit einem halbstarren Thorakoskop durchgeführt werden, dessen Design einem flexiblen Videobronchoskop oder einem starren Thorakoskop ähnelt; beide bieten eine ähnliche diagnostische Genauigkeit.
Der Patient wurde einer TAS unterzogen, die eine große Anzahl von Knötchen über der viszeralen und parietalen Pleura zeigte. Es wurde beschlossen, zum Zeitpunkt der Thorakoskopie einen Pleuraverweilkatheter (PPC) einzuführen, da die Lunge wahrscheinlich nicht erweiterbar ist.
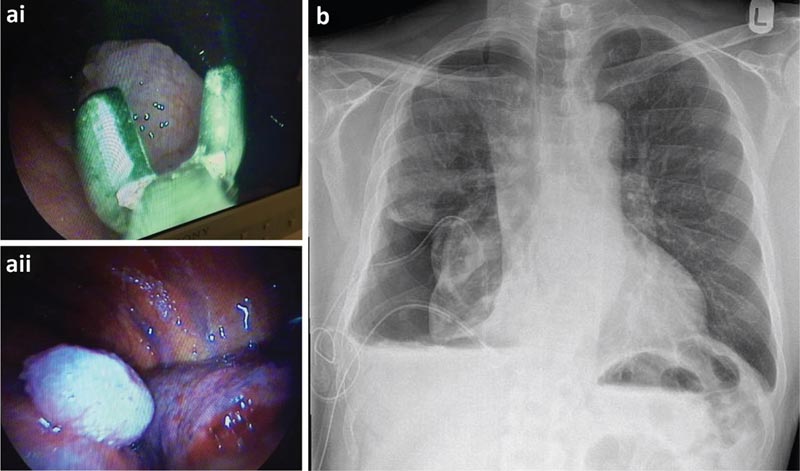
a) Biopsien der Pleura parietalis, entnommen während der Thorakoskopie und thorakoskopische Ansicht eines bösartigen Knotens. b) Postthorakoskopische Röntgenaufnahme des Brustkorbs.
Welche Rolle spielen Pleuraverweilkatheter (PPC)?
CPPs gelten als wichtiges Instrument bei der Behandlung von Pleuraergüssen. Ein CPP ist ein weicher, flexibler Silikonschlauch mit mehreren Fenstern. Bevor es in die Pleurahöhle gelangt, wird es in einen subkutanen Tunnel eingeführt.
CPPs wurden ursprünglich als Zweitlinienbehandlung für Patienten mit malignem Pleuraerguss mit nicht expandierbarer Lunge oder fehlgeschlagener Pleurodese konzipiert und können in der Pleurahöhle verbleiben und den Patienten überleben.
Eine nicht expandierbare Lunge (oder eingeschlossene Lunge) liegt vor, wenn sich die Lunge nach dem Abfluss von Pleuraflüssigkeit nicht ausdehnen kann, entweder aufgrund einer endobronchialen Obstruktion oder aufgrund einer Bedeckung der viszeralen Pleura durch einen Tumor.
Die Rolle von CPPs bei der Behandlung von Pleuraergüssen erfuhr einen Paradigmenwechsel nach der Veröffentlichung der TIME2- und AMPLE-Studien, die ihren Einsatz als Erstlinienbehandlung belegen. Sie sind sicher und verkürzen die Dauer des Krankenhausaufenthalts bei Patienten, die traditionell längere und oft mehrfache Krankenhausaufenthalte nötig gehabt hätten.
CPPs haben die Behandlung von Pleuraergüssen auf eine ambulantere Behandlung umgestellt. Die Drainage von CPPs wird vom Pflegepersonal unterstützt, Patienten können jedoch beraten und ermutigt werden, ihre eigenen Geräte zu entleeren und zu manipulieren.
Die Häufigkeit der Drainage beträgt üblicherweise 2-3 Mal pro Woche, kann aber an die Bedürfnisse des Patienten angepasst werden. Wenn das Ziel palliativ ist, kann die Drainage symptomorientiert sein. Wenn das Ziel jedoch darin besteht, eine schnelle Pleurodese mit anschließender Drainageentfernung zu erreichen, kann die tägliche Drainage zu einer höheren Rate an Autopleurodese und einer schnelleren Zeit bis zur CPP-Entfernung führen. Unter Autopleurodese versteht man die spontane Pleurodese ohne den Einsatz eines chemischen Mittels.
Obwohl dies nicht das Ziel der CPP-Insertion ist, konnte sie bei bis zu 51 % der Patienten mit malignem Pleuraerguss beobachtet werden. Darüber hinaus kann eine aggressive Drainage mit Talkverabreichung durch das CPP zu einer doppelt so hohen Pleurodeserate führen, verglichen mit der alleinigen Einführung des CPP. Die Rolle von CPPs bei nichtmalignen Pleuraergüssen ist weniger definiert und muss auf den Patienten zugeschnitten werden.
Die erste randomisierte Studie mit refraktären Pleuratranssudaten kam zu dem Schluss, dass CPPs im Vergleich zur therapeutischen Thorakozentese keine bessere Kontrolle der Dyspnoe bieten. In dieser Studie kam es im CPP-Arm zu mehr unerwünschten Ereignissen. Bei hepatischem Hydrothorax kann eine PPC mit palliativer Absicht eingesetzt werden, bei Patienten, deren medizinische Versorgung ausgeschöpft ist und nicht für eine Transplantation in Frage kommt, oder bei Patienten, die eine Überbrückungsbehandlung zur Beherrschung des Ergusses vor der Transplantation benötigen.
Da die Verwendung von CPPs immer weiter verbreitet wird, kann es bei Ärzten zu mehr Komplikationen im Zusammenhang mit ihrer Platzierung kommen, die bei 10–20 % der Patienten auftreten können. Pleurainfektionen, Katheterobstruktionen und symptomatische Lokalisationen kommen am häufigsten vor und können behandelt werden. Bei onkologischen Patienten gibt es gute Hinweise darauf, dass aufgrund einer Chemotherapie oder Immunsuppression kein erhöhtes Risiko einer CPP-bedingten Infektion besteht.
Pleurabiopsien ergaben ein malignes epitheloides Mesotheliom. Nach der Diskussion durch ein multidisziplinäres Team wurde der Patient zur Behandlung an die Onkologie überwiesen. Der Patient entleerte seinen IPC weiterhin dreimal pro Woche und erreichte anschließend eine Autopleurodese. Das CPP wurde kurz darauf entfernt.
Zusammenfassung Die Untersuchung eines einseitigen Pleuraergusses ist ein häufiges klinisches Szenario, mit dem sowohl Allgemeinmediziner als auch Pneumologen konfrontiert sind. Angesichts der hohen Prävalenz bösartiger Pleuraergüsse im Zusammenhang mit Lungenkrebs und anderen Neoplasien im fortgeschrittenen Stadium wird es immer wichtiger, die richtigen und sinnvollsten Studien durchzuführen. Dies ist besonders wichtig im Zusammenhang mit Fortschritten in der onkologischen Therapie, bei der eine allein auf der Pleurazytologie basierende Diagnose unter Umständen unzureichend ist und eine ergänzende Pleurahistologie zusätzliche Informationen (einschließlich molekularer Analysen) zur Steuerung der Behandlung liefern kann. Wie viele Aspekte der modernen Gesundheitsversorgung erfolgt die Untersuchung und Behandlung von Patienten mit Pleuraergüssen zunehmend ambulant. Durch die Einführung von Notfalldiensten am selben Tag und Pleurakliniken in vielen Krankenhäusern wird den Patienten eine optimierte, effiziente und effektive Versorgung geboten. Dies war besonders während der COVID-19-Pandemie relevant und reduziert die Kosten und das Risiko einer Krankenhausinfektion für den Patienten. Zusammen mit Geräten (wie dem CPP), die speziell für Patienten entwickelt wurden, die zu Hause bleiben möchten, hat dies die Entstehung eines modernen medizinischen Ansatzes ermöglicht. |















