Presentazione di un caso Un uomo di 67 anni con una storia di fibrillazione atriale trattata con edoxaban che aveva iniziato a peggiorare 4 settimane prima della visita, con difficoltà respiratorie. È un fumatore e consuma 40 pacchetti all’anno. Ha avuto precedenti esposizioni all’amianto a causa del suo lavoro di costruttore. Il medico ha richiesto una radiografia del torace che mostrava un versamento pleurico unilaterale (destro) di dimensioni moderate. |
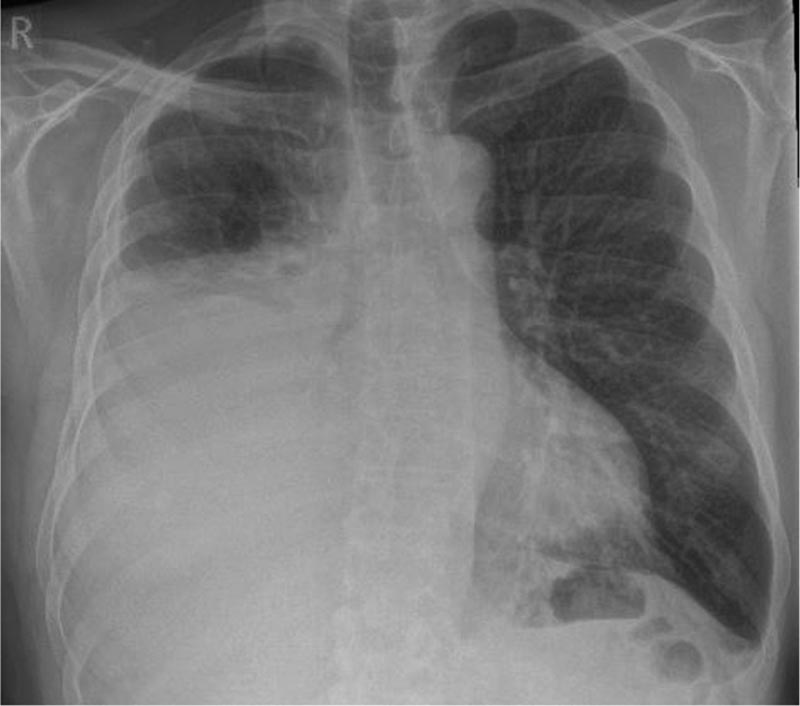
Figura 1: radiografia iniziale del torace
Qual è la causa dei sintomi di questo paziente?
Alcuni pazienti con versamento pleurico possono presentare sintomi minimi, ma altri possono manifestare mancanza di respiro con scarsa capacità di esercizio. Ciò può essere associato a una saturazione di ossigeno normale o ridotta.
La fisiologia della dispnea associata al versamento pleurico non è ben compresa, ma è probabile che contribuiscano la ridotta capacità ventilatoria e lo scambio di gas, nonché il movimento anomalo dei muscoli respiratori, con ridotta espansione della gabbia toracica. e steccatura del diaframma.
Qual è la causa del versamento pleurico?
Sebbene l’eziologia del versamento pleurico di questo paziente sia sconosciuta, alcuni fattori di rischio (inclusa una storia di fumo ed esposizione all’amianto) fanno sospettare agli autori in primo luogo un versamento pleurico maligno. Il dolore toracico omolaterale può suggerire un mesotelioma maligno.
I versamenti pleurici sono classificati in base alle loro proprietà biochimiche in essudati e trasudati, ma possono anche essere dovuti a sangue, pus e chilo.
| Cause comuni di essudati e trasudati pleurici | |
Essudati Infezione (batterica, tubercolosi e parassitaria) Tumori maligni (mesotelioma, cancro al polmone e al seno) Malattia del tessuto connettivo (artrite reumatoide) Condizioni infiammatorie indotte da farmaci (ad es., infarto polmonare) Pancreatite acuta Chilotorace |
Trasudati Insufficienza cardiaca congestizia Cirrosi epatica Fallimento renale cronico Ipoalbuminemia
|
L’applicazione dei criteri di Light può essere utile nella diagnosi di un versamento essudativo. Tuttavia, il 25% dei trasudati viene erroneamente classificato come essudato e pertanto potrebbe essere necessario calcolare il gradiente di albumina siero/liquido pleurico, per evitare diagnosi errate.
Criteri della luce per i versamenti essudativi I versamenti essudativi avranno uno o più dei seguenti elementi. > Proteine del liquido pleurico/proteine del siero > 0,5. > LDH nel liquido pleurico/LDH nel siero > 0,6. >Liquido pleurico LDH >2/3 del limite superiore dell’LDH sierico |
| LDH: lattico deidrogenasi |
I versamenti essudativi sono comunemente causati da infezioni, tumori maligni e disturbi infiammatori, come nell’artrite reumatoide. I versamenti pleurici maligni più comuni sono quelli causati da neoplasie del polmone e della mammella, che colpiscono fino al 15% dei pazienti affetti da cancro.
I versamenti del trasudato, spesso bilaterali, sono generalmente causati da uno squilibrio tra la pressione oncotica e quella idrostatica e sono associati a insufficienza cardiaca, renale o epatica. È stato dimostrato che i versamenti pleurici non maligni hanno tassi di mortalità annuali elevati. Fino al 30% dei versamenti pleurici riceve una diagnosi eziologica multifattoriale, pertanto è essenziale avere una diagnosi eziologica accurata, poiché ciò influenzerà la scelta della successiva gestione.
Una settimana dopo andò da un pneumologo .
Qual è l’intervento più opportuno?
Nei pazienti con sospetto versamento maligno non diagnosticato, è possibile eseguire un’aspirazione pleurica pianificando la linea di condotta da seguire e quale sarà l’intervento utile se il liquido pleurico presenta cellule maligne.
Edoxaban è stato sospeso per 48 ore prima della procedura a causa del rischio di sanguinamento. Dopo l’aspirazione di 1 litro di liquido pleurico, i sintomi sono migliorati. Il liquido è stato inviato al laboratorio per analisi biochimiche (proteine, lattico deidrogenasi e glucosio), microbiologiche e citologiche.
L’intervento sui versamenti pleurici può essere eseguito per scopi diagnostici e terapeutici. Se la causa dello sversamento non è chiara, deve essere presa una decisione sull’intervento più appropriato, sulla base di:
- I sintomi e/o lo stato clinico del paziente.
- L’eziologia del versamento pleurico (se accertato)
- Se sono necessari ulteriori studi.
Va notato che quando si eseguono procedure pleuriche per la rimozione dei liquidi è essenziale utilizzare l’ecografia toracica immediata o in tempo reale. Nel 2008, l’OMS ha messo in guardia contro casi di morte e danni gravi causati dall’inserimento di un drenaggio toracico.
La British Thoracic Society (BTS) ha recentemente pubblicato standard di formazione sull’ecografia toracica per i medici che si occupano anche della gestione di problemi respiratori acuti e dell’esecuzione di ecografie toraciche di emergenza.
D’altra parte, le procedure non urgenti sono controindicate in presenza di coagulopatia. Il BTS consiglia di evitare procedure nei pazienti anticoagulati finché l’INR (rapporto internazionale normalizzato) non è <1,5.
Per quanto riguarda gli anticoagulanti orali diretti , essi devono essere sospesi per 24-48 ore, a seconda della funzionalità renale e del rischio emorragico, mentre anche l’eparina terapeutica a basso peso molecolare deve essere sospesa per 24 ore.
Toracentesi diagnostica
Nella maggior parte dei pazienti, l’indagine iniziale appropriata è la toracentesi diagnostica.
Eseguita sotto guida ecografica, è una procedura mini-invasiva che consente l’analisi del liquido pleurico a scopo diagnostico. Nei versamenti pleurici maligni, la citologia del liquido pleurico ha sensibilità diagnostica variabile. Le precedenti linee guida BTS citavano un’accuratezza diagnostica del 60%, ma uno studio recente ha rilevato che la sensibilità della citologia è compresa tra circa il 45% e il 55%.
La sensibilità diagnostica è maggiore in presenza di tumori dell’ovaio, della mammella e del polmone (adenocarcinoma), rispettivamente 95%, 71% e 82%. Nel mesotelioma maligno , studi precedenti hanno mostrato una sensibilità diagnostica compresa tra il 16% e il 73%. Sebbene recentemente Arnold et al abbiano dimostrato che la sensibilità era più vicina al 6%.
Inoltre, mentre le linee guida BTS consigliano che per effettuare la diagnosi sia necessario un volume minimo di 20-40 ml di liquido pleurico, è stato dimostrato che un volume minimo di 75 ml aumenta la sensibilità diagnostica.
Anche se si ottiene una diagnosi, il materiale potrebbe non essere sempre sufficiente per marcatori molecolari/ mutazioni driver , che aiuteranno nel processo decisionale per l’immunoterapia o la terapia a bersaglio molecolare.
Toracentesi terapeutica
Toracentesi terapeutica eseguita sotto ecografia
La linea guida consente l’analisi del liquido pleurico per facilitare la diagnosi, nonché la rimozione di un volume maggiore di liquido pleurico per il sollievo sintomatico. La procedura evita l’inserimento di un drenaggio toracico e può quindi essere eseguita in regime ambulatoriale per evitare il ricovero ospedaliero. Se l’esame citologico del liquido pleurico non è diagnostico, il liquido pleurico residuo richiede una procedura importante, inclusa la biopsia pleurica guidata da immagini o la toracoscopia con anestetico locale.
Drenaggio toracico intercostale
L’inserimento del drenaggio toracico intercostale (ITD) eseguito sotto guida ecografica consente l’analisi del liquido pleurico, il drenaggio completo del versamento pleurico e la somministrazione di agenti intrapleurici, se necessario.
La pleurodesi viene comunemente indotta somministrando una sospensione di talco attraverso il drenaggio toracico intercostale per prevenire la recidiva di un versamento pleurico maligno probabile o confermato. La pleurodesi con impasto liquido di talco ha un tasso di fallimento del 24%. Questa opzione può essere appropriata per i pazienti sintomatici con versamenti pleurici di grande volume che non sono deambulanti, fragili, nei quali altri test invasivi potrebbero non essere appropriati o quando l’eziologia del versamento è nota.
Le linee guida BTS raccomandano cautela se più di 1,5 L di liquido pleurico vengono rimossi in una singola occasione a causa del rischio di sviluppare edema polmonare da riespansione, una condizione che può causare tosse, dolore toracico e persino instabilità cardiovascolare e collasso. .
Un altro allarme evidenzia la necessità di garantire un drenaggio controllato per evitare questa possibile complicazione. I medici dovrebbero tenere presente che gli interventi per il versamento pleurico, nonostante l’uso dell’ecografia toracica, dovrebbero essere evitati dopo ore, a meno che non si tratti di un’emergenza, per ridurre al minimo errori e complicanze.
Una radiografia del torace successiva alla toracentesi terapeutica ha rivelato la formazione di idropneumotorace, aumentando la possibilità di un polmone non espandibile. È stata richiesta l’analisi del fluido del versamento pleurico essudativo (proteine 40 g/l e LDH 620 UI).
L’esame citologico ha rivelato un versamento linfocitario senza cellule maligne. La tomografia computerizzata (TC) del torace ha dimostrato una corteccia pleurica parietale che comprende prevalentemente il lobo inferiore destro, probabilmente causando un polmone non espandibile.
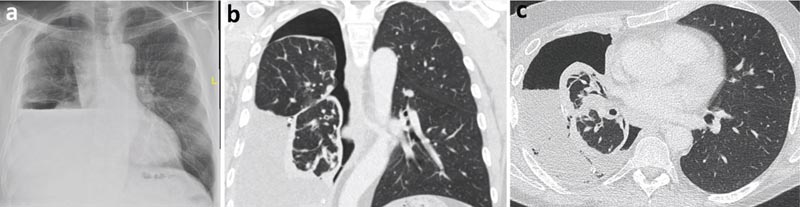
Figura 2
a) Radiografia del torace post-toracentesi con idropneumotorace (aria e liquido nella cavità pleurica).
b) TC del torace, vista coronale.
c) TC del torace, vista assiale.
Qual è il prossimo intervento più opportuno?
Poiché la citologia del liquido pleurico non era diagnostica, il paziente è stato sottoposto a toracoscopia in anestesia locale e sedazione moderata (TAS), nota anche come toracoscopia medica o pleuroscopia. È una procedura medica eseguita da pneumologi, che comprende l’esame interno, la biopsia e/o la somministrazione di agenti terapeutici nella cavità pleurica.
La sua principale indicazione è lo studio dei versamenti essudativi ad eziologia sconosciuta, in particolare quando non esiste un target pleurico per il prelievo del campione bioptico TC-guidato e della pleurodesi. È utile anche per la diagnosi della tubercolosi pleurica abbinata al prelievo per coltura e istologia, con una sensibilità fino al 100%, a seconda della prevalenza.
L’efficacia della TAS nella diagnosi di neoplasie è pari a quella della biopsia nella chirurgia toracoscopica videoassistita (VATS). Questa biopsia viene generalmente eseguita in anestesia generale e ventilazione monopolmonare. La TAS può essere utilizzata anche per indicazioni terapeutiche. La pleurodesi con talco può essere utilizzata se la pleura appare anormale all’ispezione diretta. È efficace quanto l’impasto di talco nel raggiungere la pleurodesi in modo più efficace nei pazienti con cancro ai polmoni o al seno.
La TAS può essere utile anche nelle infezioni pleuriche, consentendo la divisione dei setti e delle aderenze e aiutando a posizionare il drenaggio toracico in modo più accurato.
La TAS può essere eseguita utilizzando un toracoscopio semirigido che è simile nel design a un videobroncoscopio flessibile o a un toracoscopio rigido; entrambi forniscono un’accuratezza diagnostica simile.
Il paziente è stato sottoposto a TAS che ha evidenziato un gran numero di noduli sulla pleura viscerale e parietale. Si è deciso di inserire un catetere pleurico a permanenza (PPC) al momento della toracoscopia per un probabile polmone non espandibile.
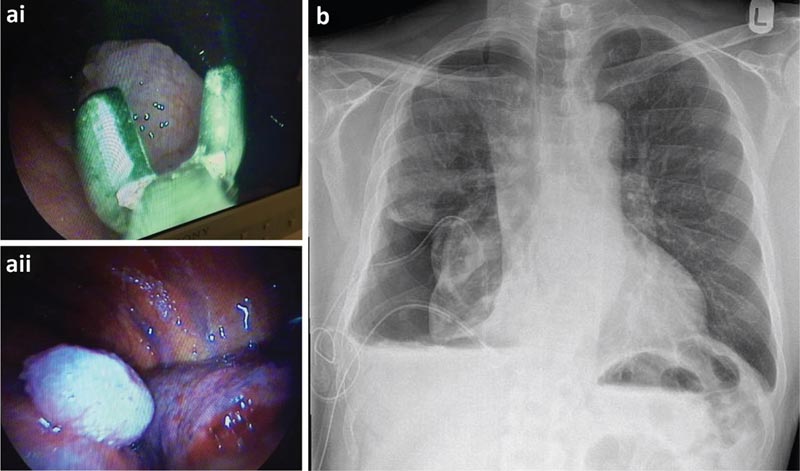
a) Biopsie della pleura parietale effettuate durante la toracoscopia e visione toracoscopica di un nodulo maligno. b) Radiografia del torace post-toracoscopica.
Qual è il ruolo dei cateteri pleurici a permanenza (PPC)?
I CPP sono considerati uno strumento importante nella gestione dei versamenti pleurici. Un CPP è un tubo in silicone morbido e flessibile con finestre multiple. Prima di entrare nella cavità pleurica, viene introdotto in un tunnel sottocutaneo.
I CPP sono stati inizialmente progettati come trattamento di seconda linea per i pazienti con versamento pleurico maligno con polmone non espandibile o pleurodesi fallita e possono rimanere nella cavità pleurica e sopravvivere al paziente.
Il polmone non espandibile (o polmone intrappolato) si verifica quando il polmone non può espandersi dopo il drenaggio del liquido pleurico, a causa di un’ostruzione endobronchiale o della copertura della pleura viscerale da parte del tumore.
Il ruolo dei CPP nel trattamento del versamento pleurico ha subito un cambiamento di paradigma in seguito alla pubblicazione degli studi TIME2 e AMPLE che ne supportano l’uso come trattamento di prima linea. Sono sicuri e riducono la durata della degenza ospedaliera in pazienti che tradizionalmente avrebbero richiesto ricoveri prolungati e spesso multipli.
I CPP hanno cambiato la gestione dei versamenti pleurici in un contesto più ambulatoriale. Il drenaggio dei CPP è assistito dal personale infermieristico, ma i pazienti possono essere consigliati e incoraggiati a drenare e manipolare i propri dispositivi.
La frequenza del drenaggio è generalmente di 2-3 volte a settimana, ma può essere adattata alle esigenze del paziente. Se l’obiettivo è palliativo, il drenaggio può essere guidato dai sintomi. Tuttavia, se l’obiettivo è ottenere una pleurodesi rapida con successiva rimozione del drenaggio, il drenaggio giornaliero può portare a un tasso più elevato di autopleurodesi e a tempi più rapidi per la rimozione del CPP. L’autopleurodesi è definita come pleurodesi spontanea senza l’uso di un agente chimico.
Sebbene non sia l’obiettivo dell’inserimento del CPP, potrebbe essere osservato fino al 51% dei pazienti con versamento pleurico maligno. Inoltre, il drenaggio aggressivo con la somministrazione di talco attraverso il CPP può comportare tassi di pleurodesi 2 volte più elevati rispetto all’inserimento del solo CPP. Il ruolo dei CPP nei versamenti pleurici non maligni è meno definito e deve essere adattato al paziente.
Il primo studio randomizzato sui trasudati pleurici refrattari ha concluso che i CPP non offrono un controllo superiore della dispnea rispetto alla toracentesi terapeutica. In quello studio, il braccio CPP ha registrato un numero maggiore di eventi avversi. Nell’idrotorace epatico, una PPC può essere posizionata con intento palliativo, per i pazienti che hanno esaurito la gestione medica e non sono candidati al trapianto, o per coloro che necessitano di un trattamento ponte per gestire il versamento prima del trapianto.
Man mano che l’uso dei CPP diventa più diffuso, i medici potrebbero riscontrare più complicazioni legate al loro posizionamento, che possono verificarsi nel 10%-20% dei pazienti. L’infezione pleurica, l’ostruzione del catetere e le loculazioni sintomatiche tendono ad essere le più comuni e possono essere trattate. Nei pazienti oncologici, vi è una buona evidenza che non vi è alcun aumento del rischio di infezione correlata al CPP a causa della chemioterapia o dell’immunosoppressione.
Le biopsie pleuriche hanno rivelato un mesotelioma epitelioide maligno. Dopo la discussione da parte di un team multidisciplinare, il paziente è stato inviato in oncologia per il trattamento. Il paziente ha continuato a drenare il suo IPC 3 volte a settimana e successivamente ha raggiunto l’autopleurodesi. Il CPP è stato rimosso poco dopo.
Riepilogo L’indagine di un versamento pleurico unilaterale è uno scenario clinico comune affrontato sia dai medici di medicina generale che dagli pneumologi. Con l’elevata prevalenza di versamenti pleurici maligni associati al cancro del polmone e ad altre neoplasie in stadio avanzato, è sempre più importante eseguire studi corretti e più utili. Ciò è particolarmente importante in relazione ai progressi nella terapia oncologica, per cui la diagnosi basata esclusivamente sulla citologia pleurica può essere insufficiente e l’istologia pleurica complementare può fornire informazioni aggiuntive (compresa l’analisi molecolare) per guidare il trattamento. Come per molti aspetti dell’assistenza sanitaria moderna, l’indagine e la gestione dei pazienti con versamenti pleurici vengono sempre più gestite su base ambulatoriale. Con l’adozione di servizi di emergenza in giornata e di cliniche pleuriche in molti ospedali, ciò fornisce ai pazienti cure snelle, efficienti ed efficaci. Ciò è stato particolarmente rilevante durante la pandemia di COVID-19 e riduce i costi e il rischio di infezioni nosocomiali per il paziente. Questo, insieme ai dispositivi (come il CPP) progettati specificamente per i pazienti che desiderano rimanere a casa, ha consentito l’emergere di un approccio moderno alla medicina. |















