Présentation d’un cas Homme de 67 ans ayant des antécédents de fibrillation auriculaire traitée par edoxaban qui avaient commencé à s’aggraver 4 semaines avant la consultation, avec des difficultés respiratoires. Il est fumeur et consomme 40 paquets par an. Il a déjà été exposé à l’amiante dans le cadre de son travail de constructeur. Le médecin demande une radiographie pulmonaire montrant un épanchement pleural unilatéral (droit) de taille modérée. |
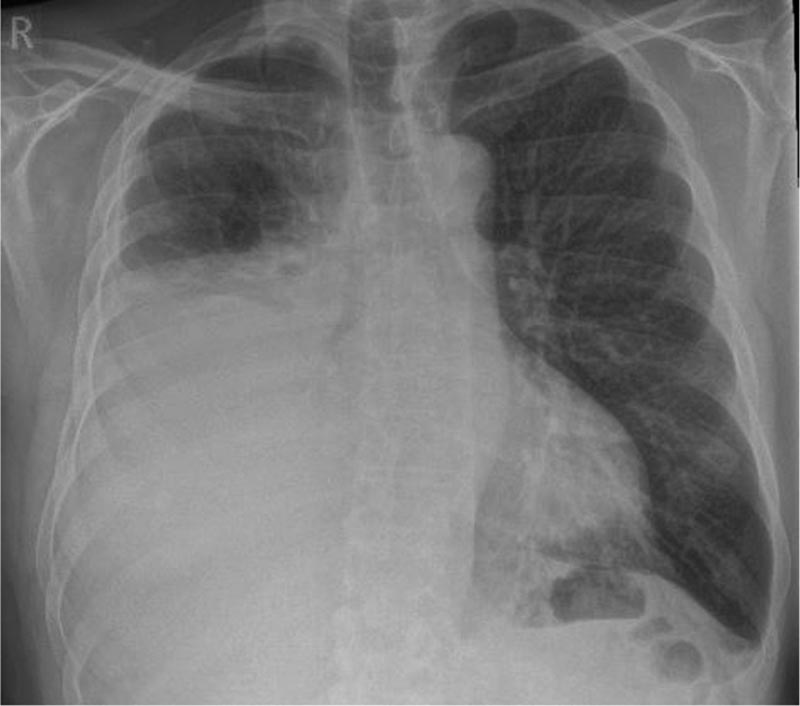
Figure 1 : Radiographie pulmonaire initiale
Quelle est la cause des symptômes de ce patient ?
Certains patients présentant un épanchement pleural peuvent présenter des symptômes minimes, mais d’autres peuvent ressentir un essoufflement et une faible capacité à faire de l’exercice. Cela peut être associé à une saturation en oxygène normale ou réduite.
La physiologie de la dyspnée associée à un épanchement pleural n’est pas bien comprise, mais une capacité ventilatoire et des échanges gazeux réduits, ainsi qu’un mouvement anormal des muscles respiratoires, avec une expansion réduite de la cage thoracique, sont susceptibles d’y contribuer. et attelle du diaphragme.
Quelle est la cause de l’épanchement pleural ?
Bien que l’étiologie de l’épanchement pleural de ce patient soit inconnue, certains facteurs de risque (notamment des antécédents de tabagisme et d’exposition à l’amiante) font suspecter en premier lieu aux auteurs un épanchement pleural malin. Une douleur thoracique homolatérale peut évoquer un mésothéliome malin.
Les épanchements pleuraux sont classés selon leurs propriétés biochimiques en exsudats et transsudats, mais ils peuvent également être dus au sang, au pus et au chyle.
| Causes courantes des exsudats et transudats pleuraux | |
Exsudats Infection (bactérienne, tuberculeuse et parasitaire) Tumeur maligne (mésothéliome, cancer du poumon et du sein) Maladie du tissu conjonctif (polyarthrite rhumatoïde) Conditions inflammatoires d’origine médicamenteuse (par exemple, infarctus pulmonaire) Pancréatite aiguë Chylothorax |
Transsudats Insuffisance cardiaque congestive Cirrhose hépatique L’insuffisance rénale chronique Hypoalbuminémie
|
L’application des critères de Light peut être utile pour diagnostiquer un épanchement exsudatif. Cependant, 25 % des transsudats sont classés à tort comme exsudats et il peut donc être nécessaire de calculer le gradient d’albumine sérum/liquide pleural, afin d’éviter un diagnostic erroné.
Critères de lumière pour les épanchements exsudatifs Les épanchements exsudatifs présenteront un ou plusieurs des éléments suivants. > Protéine du liquide pleural/protéine sérique > 0,5. > LDH dans le liquide pleural / LDH dans le sérum > 0,6. > Liquide pleural LDH > 2/3 de la limite supérieure de la LDH sérique |
| LDH : lactique déshydrogénase |
Les épanchements exsudatifs sont généralement causés par des infections, des tumeurs malignes et des troubles inflammatoires, comme dans la polyarthrite rhumatoïde. Les épanchements pleuraux malins les plus courants sont ceux provoqués par des néoplasmes du poumon et du sein, touchant jusqu’à 15 % des patients atteints de cancer.
Les épanchements transsudaux, souvent bilatéraux, sont généralement provoqués par un déséquilibre entre les pressions oncotiques et hydrostatiques et sont associés à une insuffisance cardiaque, rénale ou hépatique. Il a été démontré que les épanchements pleuraux non malins entraînent des taux de mortalité annuels élevés. Jusqu’à 30 % des épanchements pleuraux font l’objet d’un diagnostic étiologique multifactoriel, il est donc essentiel d’avoir un diagnostic étiologique précis, car cela affectera le choix de la prise en charge ultérieure.
Une semaine plus tard, il est allé voir un pneumologue .
Quelle est l’intervention la plus adaptée ?
Chez les patients présentant une suspicion d’épanchement malin non diagnostiqué, une aspiration pleurale peut être réalisée tout en planifiant la marche à suivre et quelle sera l’intervention utile si le liquide pleural contient des cellules malignes.
L’edoxaban a été arrêté 48 heures avant l’intervention en raison du risque de saignement. Après aspiration de 1 litre de liquide pleural, les symptômes se sont améliorés. Le liquide a été envoyé au laboratoire pour analyse biochimique (protéines, lactique déshydrogénase et glucose), microbiologique et cytologique.
L’intervention dans les épanchements pleuraux peut être réalisée à des fins diagnostiques et thérapeutiques. Si la cause du déversement n’est pas claire, une décision doit être prise quant à l’intervention la plus appropriée, en fonction de :
- Les symptômes et/ou l’état clinique du patient.
- L’étiologie de l’épanchement pleural (si établie)
- Si des études complémentaires sont nécessaires.
Il convient de noter que lors de procédures pleurales d’élimination de liquide, il est essentiel d’utiliser une échographie thoracique immédiate ou en temps réel. En 2008, l’OMS a mis en garde contre des cas de décès et de dommages graves causés par l’insertion d’un drain thoracique.
La British Thoracic Society (BTS) a récemment publié des normes de formation en échographie thoracique pour les cliniciens s’occupant également de la gestion des problèmes respiratoires aigus et réalisant des échographies thoraciques d’urgence.
En revanche, les interventions non urgentes sont contre-indiquées en présence de coagulopathie. Ce BTS conseille d’éviter les procédures chez les patients anticoagulés jusqu’à ce que l’INR (rapport international normalisé) soit <1,5.
Quant aux anticoagulants oraux directs , ils doivent être arrêtés pendant 24 à 48 heures, en fonction de la fonction rénale et du risque hémorragique, tandis que l’héparine thérapeutique de bas poids moléculaire doit également être arrêtée pendant 24 heures.
Thoracentèse diagnostique
Chez la plupart des patients, l’investigation initiale appropriée est la thoracentèse diagnostique.
Réalisée sous guidage échographique, il s’agit d’une procédure mini-invasive qui permet l’analyse du liquide pleural à des fins diagnostiques. Dans les épanchements pleuraux malins, la cytologie du liquide pleural a une sensibilité diagnostique variable. Les lignes directrices précédentes du BTS citent une précision diagnostique de 60 %, mais une étude récente a révélé que la sensibilité de la cytologie est d’environ 45 % à 55 %.
La sensibilité diagnostique est plus grande en présence de cancers de l’ovaire, du sein et du poumon (adénocarcinome), respectivement 95 %, 71 % et 82 %. Dans le mésothéliome malin , des études antérieures ont montré une sensibilité diagnostique comprise entre 16 % et 73 %. Bien que récemment Arnold et al aient montré que la sensibilité était plus proche de 6 %.
De plus, alors que les lignes directrices du BTS conseillent qu’un volume minimum de 20 à 40 ml de liquide pleural soit nécessaire pour poser le diagnostic, il a été prouvé qu’un volume minimum de 75 ml augmente la sensibilité du diagnostic.
Même si un diagnostic est obtenu, le matériel peut ne pas toujours être suffisant pour les marqueurs moléculaires/ mutations pilotes , ce qui facilitera la prise de décision en matière d’immunothérapie ou de thérapie moléculaire ciblée.
Thoracentèse thérapeutique
Thoracentèse thérapeutique réalisée sous échographie
Les lignes directrices permettent l’analyse du liquide pleural pour faciliter le diagnostic, ainsi que le retrait d’un plus grand volume de liquide pleural pour un soulagement symptomatique. L’intervention évite la mise en place d’un drain thoracique et peut donc être réalisée en ambulatoire pour éviter une hospitalisation. Si la cytologie du liquide pleural n’est pas diagnostique, le liquide pleural résiduel nécessite une intervention majeure, notamment une biopsie pleurale guidée par l’image ou une thoracoscopie sous anesthésie locale.
Drainage thoracique intercostal
L’insertion d’un drain thoracique intercostal (ITD) réalisée sous guidage échographique permet l’analyse du liquide pleural, le drainage complet de l’épanchement pleural et l’administration d’agents intrapleuraux, si nécessaire.
La pleurodèse est généralement induite par l’administration d’une suspension de talc par le drain thoracique intercostal pour prévenir la récidive d’un épanchement pleural malin probable ou confirmé. La pleurodèse en suspension de talc a un taux d’échec de 24 %. Cette option peut être appropriée pour les patients symptomatiques présentant des épanchements pleuraux de grand volume qui sont non ambulatoires, fragiles, chez lesquels d’autres tests invasifs peuvent ne pas être appropriés, ou lorsque l’étiologie de l’épanchement est connue.
Les lignes directrices du BTS recommandent la prudence si > 1,5 L de liquide pleural est retiré en une seule fois en raison du risque de développer un œdème pulmonaire de réexpansion, une affection pouvant provoquer de la toux, des douleurs thoraciques et même une instabilité et un collapsus cardiovasculaires. .
Une autre alerte souligne la nécessité de garantir un drainage contrôlé pour éviter cette éventuelle complication. Les cliniciens doivent noter que les interventions en cas d’épanchement pleural, malgré l’utilisation d’une échographie thoracique, doivent être évitées en dehors des heures d’ouverture, sauf en cas d’urgence, afin de minimiser les erreurs et les complications.
Une radiographie pulmonaire après thoracentèse thérapeutique a révélé la formation d’un hydropneumothorax, évoquant la possibilité d’un poumon non expansible. Une analyse liquidienne de l’épanchement pleural exsudatif a été demandée (protéines 40 g/l et LDH 620 UI).
La cytologie a révélé un épanchement lymphocytaire sans cellules malignes. La tomodensitométrie (TDM) du thorax a mis en évidence un cortex pleural pariétal englobant principalement le lobe inférieur droit, provoquant probablement un poumon non expansible.
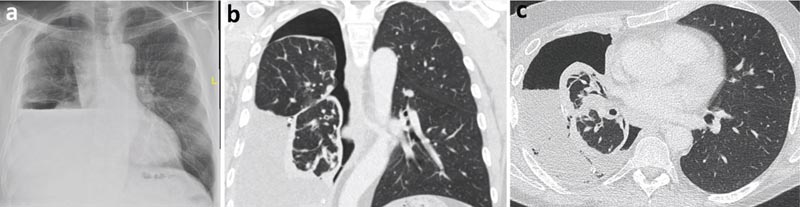
Figure 2
a) Radiographie thoracique post-thoracentèse avec hydropneumothorax (air et liquide dans la cavité pleurale).
b) Scanner thoracique, vue coronale.
c) TDM thoracique, vue axiale.
Quelle est la prochaine intervention la plus appropriée ?
La cytologie du liquide pleural n’étant pas diagnostique, le patient a subi une thoracoscopie sous anesthésie locale et sédation modérée (TAS), également appelée thoracoscopie médicale ou pleuroscopie. Il s’agit d’une procédure médicale réalisée par des pneumologues, qui comprend un examen interne, une biopsie et/ou l’administration d’agents thérapeutiques dans la cavité pleurale.
Son indication principale est l’étude des épanchements exsudatifs d’étiologie inconnue, notamment lorsqu’il n’existe pas de cible pleurale pour le prélèvement de la biopsie guidée par scanner et la pleurodèse. Il est également utile pour le diagnostic de la tuberculose pleurale associé à un prélèvement pour culture et histologie, avec une sensibilité allant jusqu’à 100 %, selon la prévalence.
L’efficacité du TAS dans le diagnostic de tumeur maligne est aussi élevée que celle de la biopsie en chirurgie thoracoscopique vidéo-assistée (VATS). Cette biopsie est généralement réalisée sous anesthésie générale et ventilation unipulmonaire. Le TAS peut également être utilisé pour des indications thérapeutiques. La pleurodèse au talc peut être utilisée si la plèvre semble anormale lors d’une inspection directe. Il est aussi efficace que la suspension de talc pour obtenir une pleurodèse plus efficace chez les patients atteints d’un cancer du poumon ou du sein.
Le TAS peut également être utile dans les infections pleurales, permettant la division des septa et des adhérences et aidant à placer le drainage thoracique avec plus de précision.
La TAS peut être réalisée à l’aide d’un thoracoscope semi-rigide dont la conception est similaire à celle d’un vidéobronchoscope flexible ou d’un thoracoscope rigide ; les deux offrent une précision diagnostique similaire.
Le patient a subi une TAS qui a montré un grand nombre de nodules au niveau des plèvres viscérales et pariétales. Il a été décidé d’insérer un cathéter pleural à demeure (CPP) au moment de la thoracoscopie pour un poumon probablement non expansible.
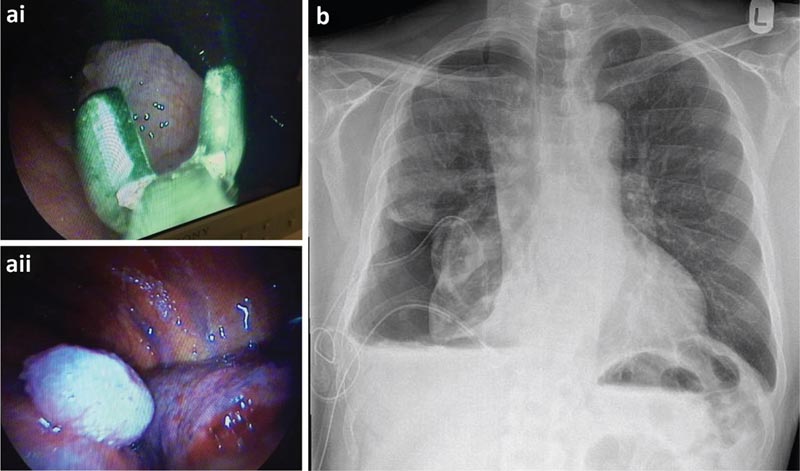
a) Biopsies de la plèvre pariétale réalisées lors d’une thoracoscopie et vue thoracoscopique d’un nodule malin. b) Radiographie pulmonaire post-thoracoscopique.
Quel est le rôle des cathéters pleuraux à demeure (CPP) ?
Les CPP sont considérés comme un outil important dans la gestion des épanchements pleuraux. Un CPP est un tube en silicone souple et flexible doté de plusieurs fenestrations. Avant de pénétrer dans la cavité pleurale, il est introduit dans un tunnel sous-cutané.
Les CPP ont été initialement conçus comme traitement de deuxième intention pour les patients présentant un épanchement pleural malin avec poumon non expansible ou échec de la pleurodèse, et peuvent rester dans la cavité pleurale et survivre au patient.
Un poumon non expansible (ou poumon piégé) se produit lorsque le poumon ne peut pas se dilater après le drainage du liquide pleural, soit en raison d’une obstruction endobronchique, soit d’une couverture de la plèvre viscérale par une tumeur.
Le rôle des CPP dans le traitement de l’épanchement pleural a connu un changement de paradigme suite à la publication des essais TIME2 et AMPLE soutenant leur utilisation comme traitement de première intention. Ils sont sûrs et réduisent la durée du séjour à l’hôpital chez les patients qui auraient traditionnellement nécessité des hospitalisations prolongées et souvent multiples.
Les RPC ont modifié la prise en charge des épanchements pleuraux vers une prise en charge plus ambulatoire. Le drainage des CPP est assisté par le personnel infirmier, mais les patients peuvent être conseillés et encouragés à drainer et à manipuler leurs propres appareils.
La fréquence des drainages est généralement de 2 à 3 fois/semaine, mais peut être adaptée aux besoins du patient. Si l’objectif est palliatif, le drainage peut alors être guidé par les symptômes. Cependant, si l’objectif est d’obtenir une pleurodèse rapide avec retrait ultérieur du drainage, un drainage quotidien peut conduire à un taux d’autopleurodèse plus élevé et à un délai plus rapide pour retirer le CPP. L’autopleurodèse est définie comme une pleurodèse spontanée sans utilisation d’agent chimique.
Bien que ce ne soit pas l’objectif de l’insertion d’un CPP, cela pourrait être observé chez jusqu’à 51 % des patients présentant un épanchement pleural malin. De plus, un drainage agressif avec administration de talc via le CPP peut entraîner des taux de pleurodèse 2 fois plus élevés que l’insertion du CPP seul. Le rôle des CPP dans les épanchements pleuraux non malins est moins défini et doit être adapté au patient.
Le premier essai randomisé sur les transsudats pleuraux réfractaires a conclu que les CPP n’offraient pas un contrôle supérieur de la dyspnée par rapport à la thoracentèse thérapeutique. Dans cet essai, le groupe RPC a connu davantage d’événements indésirables. Dans l’hydrothorax hépatique, une PPC peut être placée à visée palliative, pour les patients qui ont épuisé la prise en charge médicale et ne sont pas candidats à une greffe, ou pour ceux qui ont besoin d’un traitement de transition pour gérer l’épanchement avant la greffe.
À mesure que l’utilisation des CPP se généralise, les médecins peuvent rencontrer davantage de complications liées à leur placement, qui peuvent survenir chez 10 à 20 % des patients. L’infection pleurale, l’obstruction du cathéter et les loculations symptomatiques ont tendance à être les plus courantes et peuvent être traitées. Chez les patients en oncologie, il existe de bonnes preuves qu’il n’y a pas d’augmentation du risque d’infection liée à la DPC due à la chimiothérapie ou à l’immunosuppression.
Les biopsies pleurales ont révélé un mésothéliome épithélioïde malin. Après discussion en équipe multidisciplinaire, le patient a été orienté vers l’oncologie pour un traitement. Le patient a continué à drainer son IPC 3 fois/semaine et a ensuite réalisé une autopleurodèse. Le RPC a été supprimé peu de temps après.
Résumé L’investigation d’un épanchement pleural unilatéral est un scénario clinique courant auquel sont confrontés les médecins généralistes et les pneumologues. Avec la forte prévalence des épanchements pleuraux malins associés au cancer du poumon et à d’autres néoplasmes à un stade avancé, il est de plus en plus important de réaliser les études correctes et les plus utiles. Ceci est particulièrement important en ce qui concerne les progrès de la thérapie oncologique, où le diagnostic basé uniquement sur la cytologie pleurale peut s’avérer insuffisant et où l’histologie pleurale complémentaire peut fournir des informations supplémentaires (y compris une analyse moléculaire) pour guider le traitement. Comme pour de nombreux aspects des soins de santé modernes, l’investigation et la prise en charge des patients présentant des épanchements pleuraux sont de plus en plus gérées en ambulatoire. Avec l’adoption de services d’urgence le jour même et de cliniques pleurales dans de nombreux hôpitaux, les patients bénéficient de soins rationalisés, efficaces et efficients. Cela s’est avéré particulièrement pertinent pendant la pandémie de COVID-19 et réduit le coût et le risque d’infection nosocomiale pour le patient. Ceci, combiné aux dispositifs (tels que le CPP) spécialement conçus pour les patients qui souhaitent rester à la maison, a permis l’émergence d’une approche moderne de la médecine. |















