Hintergrund
Casirivimab und Imdevimab sind nichtkompetitive monoklonale Antikörper, die an zwei verschiedene Stellen der Rezeptorbindungsdomäne des SARS-CoV-2-Spike-Glykoproteins binden und so den Viruseintritt in Wirtszellen blockieren.
Unser Ziel war es, die Wirksamkeit und Sicherheit von Casirivimab und Imdevimab in Kombination bei hospitalisierten Patienten mit COVID-19 zu bewerten.
Methoden
RCOVERY ist eine kontrollierte, randomisierte Studie mit offener Plattform, in der mehrere mögliche Behandlungen mit der üblichen Versorgung bei Krankenhauspatienten mit COVID-19 verglichen werden.
127 britische Krankenhäuser beteiligten sich an der Bewertung von Casirivimab und Imdevimab. Teilnahmeberechtigt waren alle Patienten im Alter von mindestens 12 Jahren, die mit einem klinisch vermuteten oder im Labor bestätigten SARS-CoV-2-Infektion ins Krankenhaus eingeliefert wurden.
Die Teilnehmer wurden nach dem Zufallsprinzip (1:1) der Standardbehandlung allein oder der Standardtherapie plus 4 g Casirivimab und 4 g Imdevimab, die zusammen als einzelne intravenöse Infusion verabreicht wurden, zugeteilt. Forscher und Datenauswerter waren für die Analyse der Ergebnisdaten während der Studie blind.
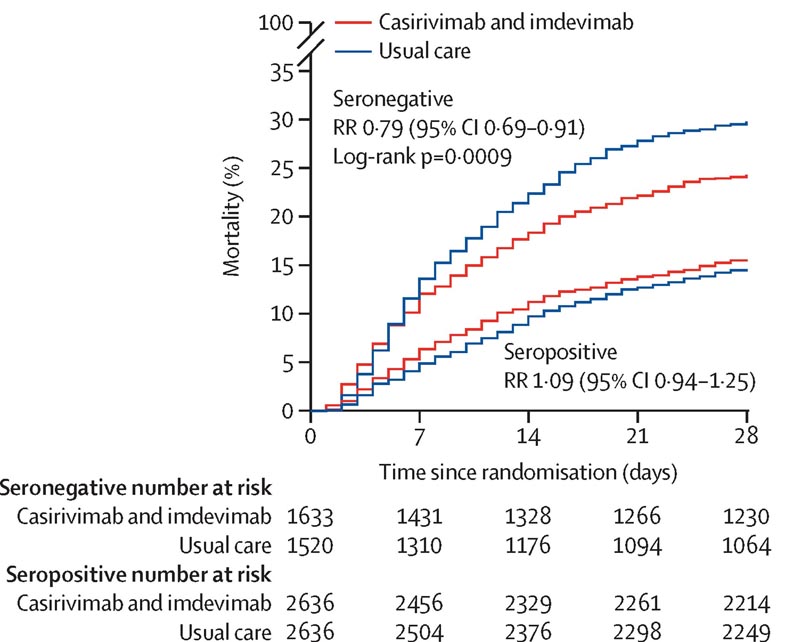
Der primäre Endpunkt war die 28-Tage-Gesamtmortalität, die auf Basis der Intention-to-Treat-Methode bewertet wurde, zunächst nur bei Patienten ohne nachweisbare Antikörper gegen die SARS-CoV-2-Infektion bei der Randomisierung (d. h. diejenigen, die seronegativ waren) und dann allgemein Bevölkerung.
Die Sicherheit wurde bei allen Teilnehmern, die Casirivimab und Imdevimab erhielten, bewertet .
Die Studie ist bei ISRCTN (50189673) und ClinicalTrials.gov (NCT04381936) registriert.
Ergebnisse
Zwischen dem 18. September 2020 und dem 22. Mai 2021 hatten 9.785 in RECOVERY aufgenommene Patienten Anspruch auf Casirivimab und Imdevimab, von denen 4.839 nach dem Zufallsprinzip Casirivimab und Imdevimab plus üblicher Pflege und 4.946 nur der üblichen Pflege zugeteilt wurden. 3.153 (32 %) der 9.785 Patienten waren seronegativ, 5.272 (54 %) waren seropositiv und 1.360 (14 %) hatten einen unbekannten Ausgangsantikörperstatus.
Von 812 (8 %) Patienten war bekannt, dass sie mindestens eine Dosis eines SARS-CoV-2-Impfstoffs erhalten hatten. In der primären Wirksamkeitspopulation seronegativer Patienten starben 396 (24 %) von 1633 Patienten, die Casirivimab und Imdevimab erhielten, im Vergleich zu 452 (30 %) von 1520 Patienten, die der Regelversorgung zugewiesen wurden, innerhalb von 28 Tagen (Rate Ratio [RR] 0 79,95 % CI 0). 69–0,91; p=0,0009).
In einer Analyse aller randomisierten Patienten (unabhängig vom Ausgangsantikörperstatus) starben 943 (19 %) der 4.839 Patienten, die Casirivimab und Imdevimab erhielten, gegenüber 1.029 (21 %) der 4.946 Patienten, die der Regelversorgung zugewiesen wurden, innerhalb von 28 Tagen (RR 0,94). , 95 %-KI 0,86–1,02, p=0,14).
Der proportionale Effekt von Casirivimab und Imdevimab auf die Mortalität unterschied sich signifikant zwischen HIV-positiven und HIV-negativen Patienten (p-Wert für Heterogenität = 0,002).
Es gab keine Todesfälle, die auf die Behandlung zurückzuführen waren, und keine signifikanten Unterschiede zwischen den Gruppen bei den vorab festgelegten Sicherheitsergebnissen wie ursachenspezifischer Mortalität, Herzrhythmusstörungen, Thrombosen oder schweren Blutungsereignissen.
Schwerwiegende Nebenwirkungen, die bei sieben (<1 %) Teilnehmern berichtet wurden, wurden vom örtlichen Prüfarzt als mit der Behandlung mit Casirivimab und Imdevimab in Zusammenhang gebracht.
Monoklonale neutralisierende Antikörper sind bei hospitalisierten COVID-19-Patienten wirksam, die keine eigene Antikörperreaktion entwickelt haben („seronegativ“), nicht jedoch bei solchen, die eine solche entwickelt haben („seropositiv“). Casirivimab + Imdevimab (von Regeneron)
|
Deutung
Bei Patienten, die mit COVID-19 ins Krankenhaus eingeliefert wurden, reduzierte die monoklonale Antikörperkombination aus Casirivimab und Imdevimab die 28-Tage-Mortalität bei Patienten, die zu Studienbeginn seronegativ waren (und daher keine eigene humorale Immunantwort entwickelt hatten), nicht jedoch bei denen, die seronegativ waren Zu Studienbeginn seropositiv. Base.
UK Research and Innovation (Medical Research Council) und National Institute for Health Research.