Arrière-plan
Le casirivimab et l’imdevimab sont des anticorps monoclonaux non compétitifs qui se lient à deux sites différents du domaine de liaison au récepteur de la glycoprotéine de pointe du SRAS-CoV-2, bloquant ainsi l’entrée du virus dans les cellules hôtes.
Notre objectif était d’évaluer l’efficacité et l’innocuité du casirivimab et de l’imdevimab administrés en association chez des patients hospitalisés atteints de COVID-19.
Méthodes
RCOVERY est un essai randomisé, contrôlé et à plateforme ouverte comparant plusieurs traitements potentiels aux soins habituels chez les patients hospitalisés atteints de COVID-19.
127 hôpitaux britanniques ont participé à l’évaluation du casirivimab et de l’imdevimab. Les participants éligibles étaient tout patient âgé d’au moins 12 ans admis à l’hôpital avec une infection par le SRAS-CoV-2 cliniquement suspectée ou confirmée en laboratoire.
Les participants ont été répartis au hasard (1:1) dans le groupe de soins standard seul ou dans le groupe de soins standard plus casirivimab 4 g et imdevimab 4 g administrés ensemble en une seule perfusion intraveineuse. Les enquêteurs et les évaluateurs de données n’ont pas été informés des analyses des données sur les résultats au cours de l’essai.
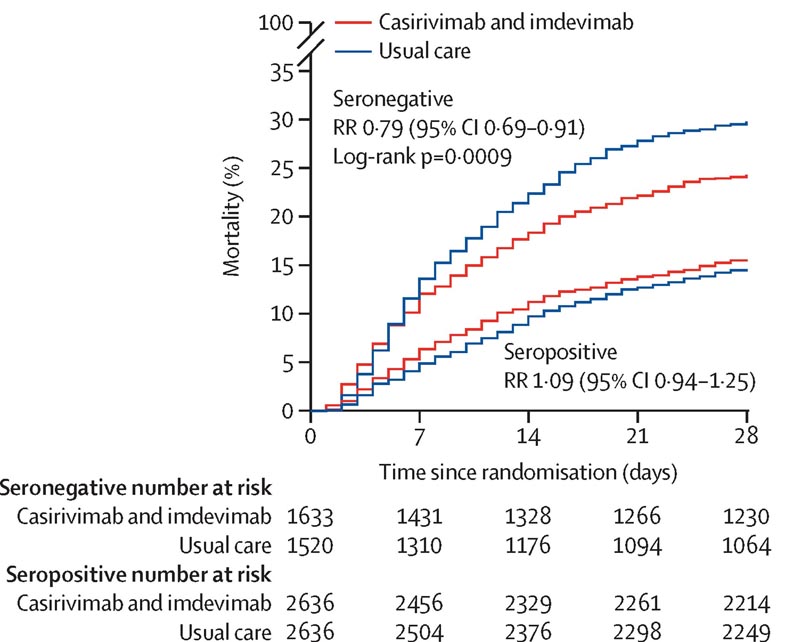
Le critère de jugement principal était la mortalité toutes causes confondues à 28 jours évaluée en intention de traiter, d’abord uniquement chez les patients sans anticorps détectables contre l’infection par le SRAS-CoV-2 au moment de la randomisation (c’est-à-dire ceux qui étaient séronégatifs), puis de manière générale. population.
L’innocuité a été évaluée chez tous les participants recevant du casirivimab et de l’imdevimab.
L’essai est enregistré auprès de l’ISRCTN (50189673) et de ClinicalTrials.gov (NCT04381936).
Résultats
Entre le 18 septembre 2020 et le 22 mai 2021, 9 785 patients inscrits dans l’étude RECOVERY étaient éligibles au casirivimab et à l’imdevimab, dont 4 839 ont été assignés au hasard au casirivimab et à l’imdevimab plus les soins habituels et 4 946 aux soins habituels seuls. 3 153 (32 %) des 9 785 patients étaient séronégatifs, 5 272 (54 %) étaient séropositifs et 1 360 (14 %) avaient un statut d’anticorps de base inconnu.
On sait que 812 (8 %) patients ont reçu au moins une dose d’un vaccin contre le SRAS-CoV-2. Dans la population d’efficacité primaire composée de patients séronégatifs, 396 (24 %) des 1 633 patients assignés au casirivimab et à l’imdevimab versus 452 (30 %) des 1 520 patients assignés aux soins habituels sont décédés dans les 28 jours (rapport des taux [RR] 0 79,95 % IC 0 69-0,91 ; p = 0,0009).
Dans une analyse de tous les patients randomisés (quel que soit le statut d’anticorps de base), 943 (19 %) des 4 839 patients assignés au casirivimab et à l’imdevimab contre 1 029 (21 %) des 4 946 patients assignés aux soins habituels sont décédés dans les 28 jours (RR 0,94). , IC à 95 % 0,86-1,02, p = 0,14).
L’effet proportionnel du casirivimab et de l’imdevimab sur la mortalité différait significativement entre les patients séropositifs et séronégatifs (valeur p pour l’hétérogénéité = 0,002).
Aucun décès n’a été attribué au traitement, ni aucune différence significative entre les groupes en ce qui concerne les critères de sécurité prédéfinis en matière de mortalité par cause, d’arythmie cardiaque, de thrombose ou d’événements hémorragiques majeurs.
Les effets indésirables graves rapportés chez sept (<1 %) participants ont été considérés par l’investigateur local comme étant liés au traitement par casirivimab et imdevimab.
Les anticorps monoclonaux neutralisants sont efficaces chez les patients hospitalisés atteints du COVID-19 qui n’ont pas développé leur propre réponse anticorps (« séronégatifs »), mais pas chez ceux qui l’ont fait (« séropositifs »). Casirivimab + imdevimab (de Regeneron)
|
Interprétation
Chez les patients admis à l’hôpital avec le COVID-19, l’association d’anticorps monoclonaux casirivimab et imdevimab a réduit la mortalité à 28 jours chez les patients séronégatifs (et n’avaient donc pas développé leur propre réponse immunitaire humorale) au départ, mais pas chez ceux qui l’étaient. séropositif au départ. base.
Recherche et innovation au Royaume-Uni (Medical Research Council) et Institut national de recherche en santé.