Le trafic de cellules immunitaires avant l’hyperglycémie est à la base de la cataratogenèse diabétique subclinique Résumé Arrière-plan Ce travail clarifie les premières causes cellulaires et moléculaires de la cataratogenèse. Le paradigme actuel présuppose des taux de glucose sanguin élevés comme condition préalable à la cataratogenèse diabétique. De nouvelles preuves dans notre modèle de cataracte diabétique remettent en question cette notion et introduisent la migration des cellules immunitaires vers le cristallin et la transformation épithéliale-mésenchymateuse (EMT) des cellules épithéliales du cristallin (LEC) comme causes sous-jacentes. Méthodes Le manque de modèles animaux appropriés a entravé les études mécanistiques sur la cataracte diabétique, car la plupart des études étaient traditionnellement réalisées sur des animaux hyperglycémiques aigus. Nous avons introduit la cataracte diabétique chez le rat du Nil (NGR) qui développe spontanément un diabète de type 2 (DT2) et montré sa proximité avec la condition humaine. La microscopie stéréoscopique spécialisée avec double éclairage en champ clair a révélé de nouvelles microlésions hyperréfléchissantes en forme de points dans les régions corticales internes du cristallin. Pour étudier la migration des cellules immunitaires vers le cristallin, nous avons développé une technique unique de microscopie in situ du globe oculaire interne en combinaison avec l’immunohistochimie. Résultats Contrairement au paradigme existant, chez environ la moitié des animaux, les microlésions hyperréfléchissantes en forme de points nouvellement introduites ont précédé l’hyperglycémie. Bien que les animaux soient normoglycémiques, nous avons constaté des changements significatifs dans leur test oral de tolérance au glucose (OGTT), révélateurs du stade prédiabétique. Les microlésions étaient accompagnées d’une migration significative de cellules immunitaires des corps ciliaires vers le cristallin, comme l’a révélé notre nouvelle technique de microscopie in situ. Les cellules immunitaires adhèrent à la surface du cristallin, certaines traversent la capsule du cristallin et se localisent avec les noyaux apoptotiques des cellules épithéliales du cristallin (LEC). Les dégradations extracellulaires, les accumulations de matériaux amorphes et les modifications des expressions de la E-cadhérine ont montré une transformation épithéliale-mésenchymateuse (EMT) dans les LEC. Par la suite, la désintégration des fibres du cristallin et la progression de la cataracte se sont étendues aux cataractes sous-capsulaires corticales, postérieures et antérieures. |
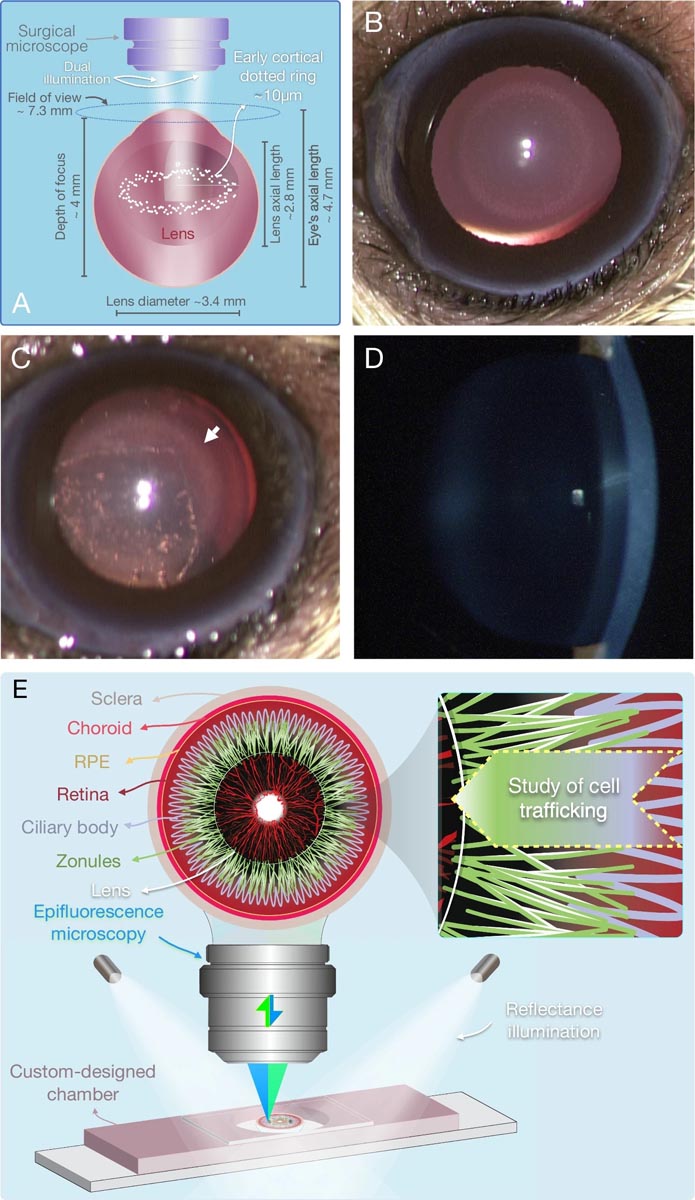
Figure : Nouvelles technologies habilitantes dans les images de la cataracte. Un schéma de double illumination, nécessaire à la visualisation stéréomicroscopique des nouvelles microlésions hyperréfléchissantes. B Image en champ clair des premières microlésions détectables in vivo dans la cataracte diabétique au stade de l’anneau ponctué. C Stéréomicroscopie du CEP et des microlésions hyperréfléchissantes (flèche). D Manque de contraste pour les microlésions ponctuelles en biomicroscopie à lampe à fente. E Aperçu de la nouvelle technique de microscopie du demi-globe antérieur pour imager les zonules intactes dans leur position d’origine. Les illuminateurs externes associés à la microscopie à épifluorescence fournissent une image 3D combinée des corps ciliaires, des zonules et des cellules migratrices.
Conclusions
Nos résultats établissent un nouveau rôle pour les cellules immunitaires dans la transformation et la mort des LEC. Le fait que la formation de la cataracte précède l’hyperglycémie remet en question le paradigme dominant selon lequel le glucose initie ou est nécessaire pour initier la pathogenèse.
De nouvelles preuves montrent que les complications moléculaires et cellulaires du diabète commencent pendant l’état prédiabétique. Ces résultats ont des conséquences prévisibles pour le diagnostic précoce, la prévention et le développement de nouvelles stratégies de traitement chez les patients diabétiques.
commentaires
Les nouvelles découvertes des chercheurs du Brigham and Women’s Hospital, membre fondateur du système de santé Mass General Brigham, contredisent les notions antérieures sur le rôle du sucre dans le développement de la cataracte diabétique. En utilisant un modèle animal qui récapitule plus fidèlement le diabète de type 2 chez l’homme, l’équipe de recherche a découvert des signes précoces de lésions oculaires avant l’apparition du diabète de type 2, ce qui suggère que les complications diabétiques peuvent commencer pendant l’état prédiabétique. . Les résultats sont publiés dans le Journal of Biomedical Science .
Un piège dans le processus scientifique n’est pas qu’une théorie puisse être fausse, mais qu’elle soit considérée comme acquise lorsqu’elle semble logique et n’est pas contestée par de nouvelles expériences », a déclaré Ali Hafezi-Moghadam, MD, PhD, directeur de Molecular Biomarkers Nano. . -Laboratoire d’imagerie (MBNI) du département de radiologie de Brigham et professeur agrégé à la Harvard Medical School. "Les preuves que nous avons rassemblées ici remettent en question la théorie de longue date de la cataracte diabétique et nous prient de réexaminer le dogme actuel sur lequel on s’appuie pour expliquer les cataractes associées au diabète."
La cataracte, l’opacification du cristallin de l’œil, est la principale cause de cécité dans le monde et constitue une complication courante du diabète de type 2. L’hypothèse actuelle derrière le développement de la cataracte diabétique est appelée « hypothèse du sucre » et suggère que l’hyperglycémie, une caractéristique du diabète, précède le développement de la cataracte. Les hypothèses de travail qui sous-tendent l’hypothèse du sucre décrivent que des niveaux plus élevés de glucose dans le cristallin des personnes atteintes de diabète sont convertis en une molécule d’alcool de sucre appelée sorbitol, qui induit des changements structurels dans le cristallin qui précèdent le développement de la cataracte. Bien que cela ne soit pas prouvé, les chercheurs approfondissent rarement cette théorie en raison de la nature traitable de la cataracte.
Hafezi-Moghadam et ses collègues ont étudié le rat du Nil, un modèle qui, selon eux, développe spontanément un diabète de type 2 lorsqu’il est gardé en captivité et ressemble beaucoup à la maladie chez l’homme. Comme les humains atteints de diabète de type 2, ces animaux développent d’abord une résistance à l’insuline et des taux d’insuline élevés dans le sang avant que leur glycémie ne dépasse la normale. À l’aide d’une technique spécialisée appelée microscopie stéréoscopique à double éclairage en champ clair, les chercheurs ont observé le développement de microlésions en forme de points, prédisposées à la formation de cataracte, dans les régions corticales internes du cristallin. De manière inattendue, ils ont remarqué que chez près de la moitié des animaux testés, ces microlésions sont apparues avant que les animaux ne développent une hyperglycémie, ou une glycémie élevée, ce qui suggère que ce n’est pas une glycémie élevée qui a conduit au développement de cataractes.
Au lieu de cela, les chercheurs ont identifié que les cellules immunitaires migraient des structures spécialisées de l’œil appelées corps ciliaires vers le cristallin. Dans ces zones, où les cellules immunitaires traversaient la capsule du cristallin, ils ont constaté que les cellules épithéliales qui recouvrent normalement la surface interne de la capsule du cristallin changeaient d’identité et se comportaient différemment. Ces changements, également connus sous le nom de transformation épithéliale-mésenchymateuse (EMT), ont été suivis d’une croissance cellulaire apparemment désorganisée, d’une mort cellulaire et d’une migration cellulaire vers le corps du cristallin. Dans certaines régions, les cellules nouvellement transformées ont simplement abandonné leur position d’origine et se sont dirigées vers la lentille. De tels changements cellulaires, aussi petits soient-ils, compromettent considérablement le fonctionnement du cristallin.
Bien qu’il soit encore trop tôt pour dire exactement ce qui provoque le comportement des cellules immunitaires et des cellules épithéliales, les chercheurs concluent que leur étude appelle à une enquête plus approfondie sur les théories dominantes. Cela pourrait également rapprocher la communauté médicale de la compréhension des mécanismes cellulaires à l’origine des complications du diabète au stade prédiabétique de la maladie. Et une fois que nous aurons compris la pathogenèse, prédit Hafezi-Moghadam, nous pourrons commencer à chercher comment empêcher les personnes atteintes de diabète de développer des cataractes et potentiellement d’autres complications ailleurs dans le corps.
"Bien que les cataractes soient aujourd’hui facilement enlevées par chirurgie, cette procédure comporte un risque de complications et est coûteuse, tant pour les individus que pour notre système de santé", a déclaré Hafezi-Moghadam. « Avec plus de 500 millions de personnes dans le monde et 37 millions d’Américains souffrant de diabète, dont la grande majorité est de type 2, il y a une incitation à essayer de trouver des moyens non chirurgicaux pour prévenir, retarder ou même inverser cette complication. . Peut-être qu’un jour il sera possible d’éviter complètement ces interventions chirurgicales. Et cela nous oblige à revenir aux bases des processus cellulaires qui sous-tendent le développement de la cataracte.
Financement : Ce travail a été soutenu par NIH Impact Award (DK108238-01, AHM) et FRDJ)