Résumé Le syndrome douloureux du grand trochanter est une cause fréquente de douleur latérale de la hanche et englobe un spectre de troubles, notamment la bursite trochantérienne, la pathologie du tendon ravisseur et la coxa saltans externe . Le syndrome douloureux du grand trochanter est avant tout un diagnostic clinique, et un examen clinique minutieux est essentiel pour un diagnostic et un traitement précis. Une anamnèse complète et un examen physique peuvent être utilisés pour aider à différencier le syndrome douloureux du grand trochanter des autres causes courantes de douleur à la hanche, telles que l’arthrose, le conflit fémoro-acétabulaire et la sténose lombaire. Bien qu’elles ne soient pas nécessaires au diagnostic, les radiographies simples et l’IRM peuvent être utiles pour exclure d’autres pathologies ou orienter le traitement du syndrome douloureux du grand trochanter. La plupart des patients atteints du syndrome douloureux du grand trochanter répondent bien au traitement conservateur , notamment à la physiothérapie, aux anti-inflammatoires non stéroïdiens et aux injections de corticostéroïdes. La prise en charge chirurgicale est généralement indiquée chez les patients présentant des symptômes chroniques réfractaires au traitement conservateur. Un large éventail d’options chirurgicales, tant ouvertes qu’endoscopiques, sont disponibles et doivent être guidées par l’étiologie spécifique de la douleur. |
Le syndrome douloureux du grand trochanter (GTPS) est un terme général utilisé pour décrire les troubles de l’espace péritrochantérien, notamment la bursite trochantérienne, la pathologie du tendon ravisseur et la coxa saltans externe. Le GTPS est une cause fréquente de douleur et de sensibilité latérales de la hanche, avec une incidence annuelle pouvant atteindre 1,8 pour 1 000 adultes en milieu de soins primaires. Bien que le GTPS soit observé dans toutes les tranches d’âge, il touche le plus souvent les patients entre la quatrième et la sixième décennie de la vie, avec une prédominance féminine.
Bien que le traitement conservateur soit efficace pour la plupart des patients atteints de GTPS, beaucoup présentent des symptômes réfractaires à la physiothérapie, aux anti-inflammatoires non stéroïdiens (AINS) et aux injections de corticostéroïdes (CSI). Compte tenu de la nature hétérogène du GTPS, un diagnostic précis de l’étiologie spécifique du GTPS et du degré de lésion du tendon fessier est essentiel pour orienter le traitement approprié. Le but de cette revue est de mettre en évidence les résultats cliniques et radiographiques qui peuvent différencier le GTPS des autres causes de douleur latérale de la hanche et guider la prise en charge. De plus, les indications, les techniques et les résultats du traitement opératoire et conservateur sont décrits.
Méthodes
Deux auteurs (MAP et JS) ont effectué une recherche dans PubMed/MEDLINE en utilisant les termes « syndrome douloureux du grand trochanter », « bursite trochantérienne » et « tendinopathie fessière ». La recherche n’a été limitée par date que jusqu’au 17 février 2021.
Étiologie et facteurs de risque
Historiquement, la plupart des patients présentant des douleurs et une sensibilité dans la hanche latérale ont reçu un diagnostic de bursite trochantérienne , qui fait référence à une inflammation de la bourse sous-fessière située profondément dans la bandelette ilio-tibiale (ITB) et les tendons. ravisseurs (Figure 2). Cependant, les études radiographiques et histopathologiques ont montré que les poches trochantériennes sont rarement atteintes isolément ; la tension de la bourse est plutôt plus souvent associée à une tendinopathie des ravisseurs .
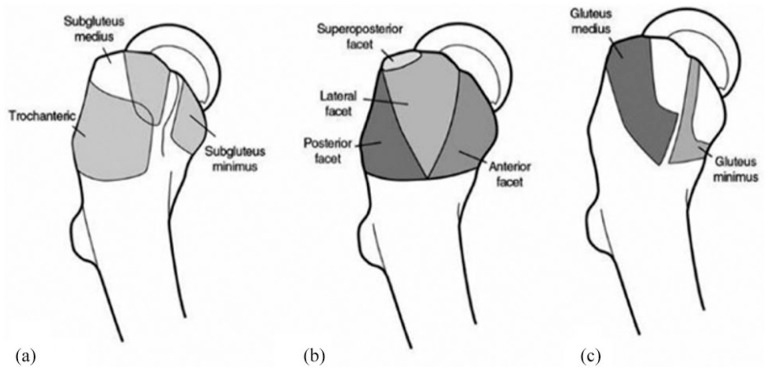
Figure : Anatomie du grand trochanter. (a) Trois bourses péritrochantériennes, (b) facettes osseuses du grand trochanter et (c) sites d’insertion des tendons ravisseurs.
On pense que le GTPS se développe à partir du frottement de la bandelette ilio-tibiale (ITB) sur le grand trochanter, conduisant à un microtraumatisme régional avec surutilisation. Comme indiqué ci-dessus, la tendinopathie des abducteurs de la hanche est couramment impliquée dans le GTPS. Les découvertes de dégénérescence tendineuse et de bursite associée dans l’appareil abducteur de la hanche ont invité à des comparaisons avec une tendinopathie de la coiffe des rotateurs de l’épaule comme processus pathologique analogue possible, avec une progression éventuelle vers des déchirures tendineuses partielles et complètes.
La coxa saltans externe , ou claquement externe de la hanche, est caractérisée par un clic palpable de l’ITB ou du grand fessier lorsqu’il se déplace de l’arrière vers l’avant sur le grand trochanter avec flexion de la hanche et d’avant vers l’arrière avec la flexion de la hanche. extension. Ceci est souvent attribué à un épaississement de la face postérieure de l’ITB ou du bord antérieur du grand fessier, et des clics répétés peuvent entraîner une irritation de la bourse trochantérienne, une tendinopathie fessière et, par conséquent, une douleur latérale de la hanche. Plus rarement, le GTPS peut résulter d’un traumatisme contondant à la hanche ou d’une blessure iatrogène lors d’une arthroplastie de la hanche.
Plusieurs facteurs de risque ont été associés au GTPS, notamment l’âge croissant, l’obésité, l’arthrose du genou ou de la hanche, les lombalgies et la différence de longueur des jambes. Ces résultats suggèrent qu’une altération de la mécanique des membres et des vecteurs de force anormaux au niveau de la hanche contribuent probablement au développement du GTPS. De même, on pense que la prévalence plus élevée du GTPS chez les femmes est liée aux différences de taille et de forme du bassin, des trochanters plus larges créant une plus grande pression sur l’ITB. Le GTPS a également été associé à une moindre restriction osseuse de la hanche, où l’instabilité peut contribuer à une plus grande tension dans les muscles fessiers. Les patients signalant des niveaux de douleur élevés présentent une stabilité de la hanche considérablement altérée par rapport à ceux signalant des niveaux de douleur plus faibles.
Antécédents et examen physique
Le GTPS se présente classiquement comme une douleur latérale chronique de la hanche dans la région du grand trochanter qui peut irradier vers la fesse ou sur le côté latéral de la cuisse jusqu’au genou. La douleur est souvent décrite comme profonde et persistante et est exacerbée par le fait de s’allonger sur le côté affecté, de s’accroupir, de s’asseoir avec la jambe homolatérale croisée et de monter les escaliers. Bien que rares, les patients atteints de GTPS après un traumatisme contondant sont susceptibles de signaler des antécédents de blessure ou de présenter des ecchymoses ou un hématome de la hanche latérale. Des antécédents de faiblesse des ravisseurs après une arthroplastie de la hanche peuvent représenter une lésion iatrogène des tendons des ravisseurs ou du nerf fessier supérieur. Il a été démontré que les facteurs psychosociaux affectent la gravité des symptômes chez les patients atteints de GTPS et doivent être évalués et pris en compte.
Un examen physique complet de la colonne lombaire, des hanches et des genoux est essentiel pour réduire le différentiel chez les patients présentant des douleurs à la hanche. La palpation de la région postérolatérale du grand trochanter provoque classiquement une sensibilité focale chez les patients atteints de GTPS, car elle coïncide avec l’empreinte anatomique du moyen fessier sur la face postéro-supérieure du grand trochanter.
Le test de flexion, d’abduction et de rotation externe (FABER), le test d’Ober et l’abduction avec résistance (figure) peuvent également provoquer une douleur ou une sensibilité trochantérienne. Les patients doivent être évalués pour déceler un signe de Trendelenburg pendant la marche ou en position sur une jambe (Figure), ce qui peut indiquer une faiblesse des ravisseurs . La position sur une jambe, considérée comme positive avec reproduction de la douleur dans les 30 secondes, présentait une sensibilité de 38 % et une spécificité de 100 % pour le GTPS.
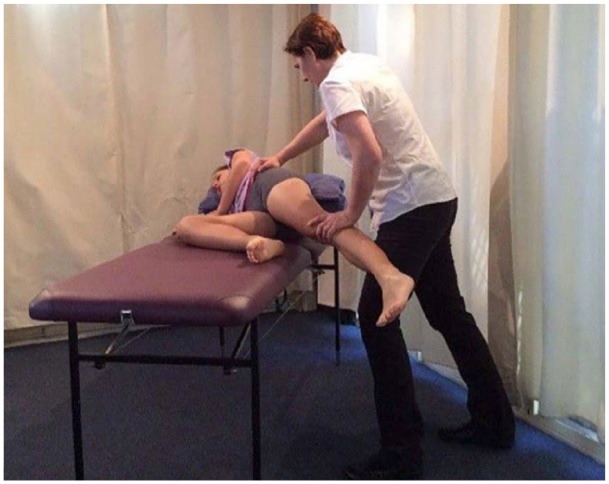
Chiffre . Évaluation de la force des abducteurs de hanche. Le patient est allongé en décubitus latéral, le côté affecté tourné vers le haut. La hanche et le genou étant étendus, l’examinateur demande au patient de réaliser une abduction de hanche avec résistance .
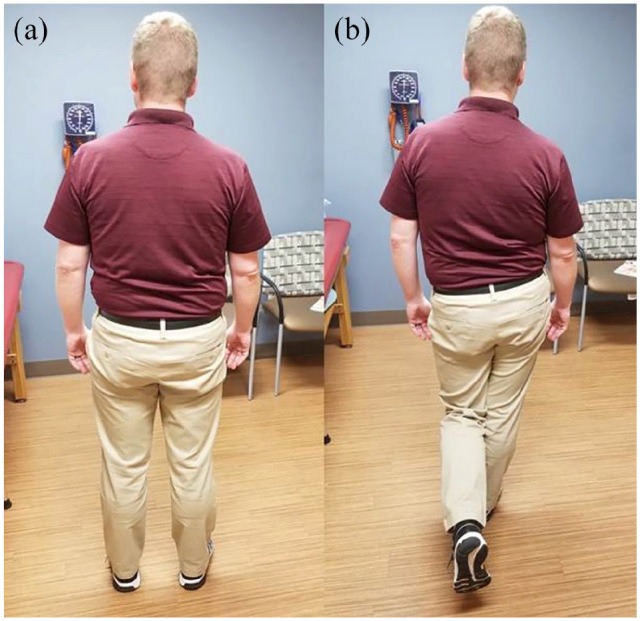
Chiffre . Test de Trendelenburg . À partir de (a) la position debout, (b) il est demandé au patient de se tenir debout sur la jambe affectée et de soulever le pied controlatéral du sol. Le test est considéré comme positif si le bassin controlatéral s’incline vers le bas, indiquant une faiblesse des ravisseurs .
L’évaluation clinique du GTPS doit également se concentrer sur la détermination de l’étiologie spécifique et de la gravité pour éclairer une prise en charge appropriée.
Les patients atteints de coxa saltans externe présentent souvent un claquement palpable, et dans certains cas observable, de l’ITB sur le grand trochanter. Alors que les patients se portent généralement volontaires pour reproduire le clic, l’examinateur peut le reproduire en plaçant le patient en décubitus latéral et en palpant le grand trochanter pendant que le patient fléchit activement la hanche. Le diagnostic est confirmé si le clic s’arrête alors qu’une pression est appliquée sur l’ITB au niveau du grand trochanter.
Les déchirures du tendon abducteur se manifestent souvent par une démarche anormale et une faible abduction de la hanche. Dans une revue de 24 patients présentant un diagnostic clinique de GTPS, Bird et al. ont constaté que le signe de Trendelenburg est le test clinique le plus sensible (73 %) et spécifique (77 %) dans le diagnostic des déchirures partielles et totales du tendon du moyen fessier. La présence d’un signe de Trendelenburg a également été associée à un besoin accru d’intervention chirurgicale. Lequesne et coll. Ils ont également constaté que la position sur une jambe a une sensibilité de 100 % et une spécificité de 97 % dans le diagnostic du GTPS chronique réfractaire dû à des déchirures du tendon ravisseur.
Diagnostic différentiel
Le diagnostic différentiel des douleurs latérales de hanche est large. Les sources intra-articulaires comprennent l’arthrose, la nécrose avasculaire, les déchirures labrales, le conflit fémoro-acétabulaire, les fractures de stress du col fémoral et les corps lâches. Alors que la douleur intra-articulaire de la hanche est souvent référée à l’ aine , à l’avant de la cuisse et au genou, une analyse rétrospective de 51 patients présentant des preuves d’une source de douleur intra-articulaire a révélé que 27 % des patients ont ressenti une douleur référée sur le côté de la cuisse. . Il est particulièrement important de distinguer la douleur associée à l’arthrose du GTPS étant donné que ces affections sont souvent comorbides.
En plus du GTPS, les causes extra-articulaires de douleur latérale de la hanche comprennent la sténose lombaire et la méralgie paresthésique. La radiculopathie des membres inférieurs résultant d’une sténose lombaire peut être difficile à distinguer du GTPS ; le schéma de douleur référée dans le GTPS peut chevaucher la distribution des dermatomes L2-4 ; et la sténose peut également conduire à une faiblesse des ravisseurs avec une démarche de Trendelenburg.
La prévalence du GTPS chez les patients référés aux centres orthopédiques du rachis pour des lombalgies atteint 51 %. La sténose lombaire peut être cliniquement différenciée du GTPS par d’autres caractéristiques, notamment des lombalgies, des paresthésies, une faiblesse focale, des douleurs radiculaires dans les membres inférieurs et un manque de sensibilité au niveau du grand trochanter.
La meralgie paresthésique décrit la neuropathie du nerf cutané fémoral latéral et se manifeste par des douleurs, des engourdissements et une dysesthésie au niveau de la hanche et de la cuisse antérolatérales. Les signes cliniques qui différencient la meralgie paresthésique du GTPS comprennent une sensibilité au niveau du ligament inguinal latéral et la présence du signe de Tinel médial et inférieur à l’épine iliaque antéro-supérieure. L’administration d’un bloc nerveux anesthésique local peut aider à confirmer le diagnostic de méralgie paresthésique.
Images
Bien que le GTPS soit généralement un diagnostic clinique , des radiographies sont régulièrement obtenues pour exclure une pathologie alternative ou concomitante, telle que l’arthrose, un conflit fémoro-acétabulaire ou une spondylose lombaire. Des irrégularités à la surface du grand trochanter et des calcifications du tendon fessier ont été décrites chez des patients atteints de GTPS. Les radiographies simples sont principalement utiles pour le diagnostic d’autres sources de douleur à la hanche, notamment l’arthrose, la nécrose avasculaire, le conflit fémoro-acétabulaire et l’arthrose lombaire.
L’IRM représente la modalité d’imagerie de référence pour le diagnostic du GTPS, car les études ont systématiquement démontré de fortes corrélations entre l’interprétation des images et les résultats peropératoires . Dans une évaluation rétrospective de 74 hanches, Cvitanic et al. 36 ont rapporté que l’IRM est précise à 91 % pour le diagnostic des déchirures des ravisseurs, avec une sensibilité de 93 % et une spécificité de 92 %. Les signes caractéristiques des déchirures complètes du tendon fessier comprennent une rupture du tendon avec ou sans rétraction, une atrophie musculaire et une dégénérescence graisseuse. Les déchirures partielles présentent une atténuation ou un amincissement du tendon sur les images pondérées en T1 et une augmentation de l’intensité du signal associée sur les images pondérées en T2.
La tendinopathie en l’absence de déchirure se caractérise par un épaississement du tendon ou une augmentation de l’intensité du signal sur les images pondérées T2. L’atteinte de la bourse associée est caractérisée par une distension et une inflammation de la bourse. Il est important de noter que les signes d’œdème péritrochantérien et de liquide de la bourse à l’IRM sont généralement présents dans les hanches asymptomatiques , avec des taux de détection allant de 65 % à 88 %. Cela souligne l’importance d’une évaluation clinique complète dans le diagnostic du GTPS. Compte tenu de la pathologie variable du GTPS, il est recommandé de réaliser une IRM et de la corréler avec les résultats cliniques avant de procéder au traitement chirurgical.
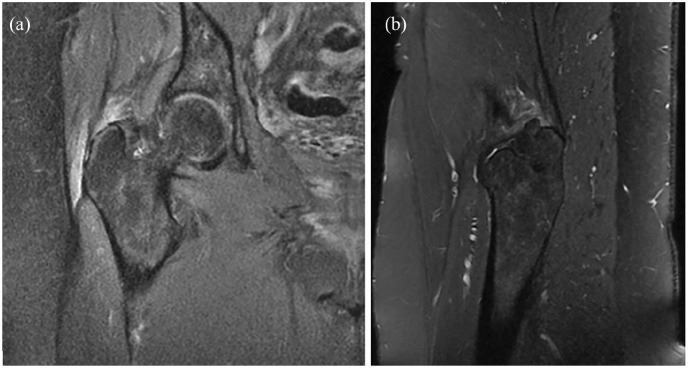
Figure (a) Densité protonique coronaire supprimée et (b) séquences sagittales pondérées en T2 en IRM de la hanche droite montrant une déchirure partielle de haut grade des tendons moyen et petit fessier avec tendinose et bursite sous-jacentes au trochanter. Le patient a donné son consentement pour la publication de cette image .
L’échographie s’est également révélée efficace dans le diagnostic du GTPS, avec une sensibilité de 79 % et 61 % pour le diagnostic de déchirure du tendon fessier et de pathologie de la bourse, respectivement. Les signes caractéristiques des déchirures du tendon fessier comprennent des défauts anéchoïques d’épaisseur partielle ou totale au sein du tendon. Il peut également y avoir une perte de masse musculaire et une échogénicité accrue due à une dégénérescence graisseuse. La tendinose est caractérisée par une échogénicité hétérogène et un épaississement du tendon avec ou sans calcifications. De plus, des accumulations de liquide de la bourse et un épaississement peuvent être observés. L’évaluation dynamique par échographie peut également être utile dans le bilan de la douleur latérale de la hanche, y compris la confirmation du diagnostic de coxa saltans externe . L’évaluation échographique offre plusieurs avantages, notamment un faible coût et la possibilité de localiser et d’administrer avec précision les corticostéroïdes.
Prise en charge non opératoire
Le traitement de première intention du GTPS est de nature conservatrice et la plupart des patients répondent à une combinaison de modification de l’activité, de physiothérapie, d’AINS et d’injection de corticostéroïdes (CSI) . Fury et coll. ont rapporté un groupe de 33 patients GTPS traités de manière conservatrice pendant au moins 6 mois et ont constaté des améliorations significatives de la douleur moyenne et des scores de l’échelle visuelle analogique (EVA) jusqu’à 12 mois. De plus, cinq des six patients qui exerçaient des métiers exigeant une activité physique intensive ont pu reprendre leur emploi précédent. Mellor et coll. 44 ont constaté que 79 % des patients traités par modification de l’activité et thérapie par l’exercice ont signalé une amélioration globale de leur état à un an, contre 52 % des patients traités par observation seule.
Dans une revue systématique évaluant l’efficacité de l’injection de corticostéroïdes (CSI) dans le traitement du GTPS, les taux d’amélioration de la douleur et de retour au niveau d’activité de base variaient de 49 % à 100 %. En résumé, les injections semblent être un traitement efficace et sûr pour le GTPS et sont associées à un faible taux de complications, la douleur locale, l’irritation cutanée et l’enflure étant les complications les plus fréquemment signalées.
La thérapie extracorporelle par ondes de choc (ESWT) a montré des résultats prometteurs dans plusieurs études.
Les preuves étayant l’utilisation d’ injections de plasma riche en plaquettes (PRP) dans le traitement du GTPS sont limitées. Dans une revue systématique de cinq articles et de quatre résumés publiés portant sur 209 patients traités par injections de PRP, Ali et al. ont conclu que le PRP représente un traitement potentiellement viable, bien que les preuves actuelles soient basées sur un petit échantillon et des études de faible qualité.
Prise en charge chirurgicale
La prise en charge chirurgicale du GTPS est généralement réservée aux patients présentant des symptômes persistants depuis au moins 6 à 12 mois et qui restent réfractaires au traitement conservateur. Avant la chirurgie, une IRM doit être obtenue pour guider la prise en charge appropriée à la source spécifique de la douleur. Plusieurs séries de cas ont décrit une bursectomie ouverte et endoscopique avec ou sans libération d’ITB pour le traitement de la bursite trochantérienne et de la tendinopathie fessière avec de bons résultats. Une technique chirurgicale similaire a été décrite pour la coxa saltans externe . Pour les déchirures partielles et totales des tendons abducteurs, une bursectomie ouverte et endoscopique et une réparation tendineuse ont été décrites. L’augmentation tendineuse par allogreffe ou transfert musculaire est généralement réservée aux cas de rétraction tendineuse importante ou d’atrophie musculaire sévère.
Conclusion
|















