Points clés Quelles sont les associations temporelles entre un indice de masse corporelle (IMC) plus élevé et une inflammation chronique et/ou une hyperinsulinémie ? Résultats Dans cette revue systématique et méta-analyse de 5 603 participants dans 112 cohortes provenant de 60 études, l’association entre les niveaux d’insuline à jeun de la période 1 (plus tôt) et l’IMC de la période 2 (plus tard) était positive et significative : pour chaque changement d’unité de SD au cours de la période 1. niveau d’insuline, il y a eu un changement associé conséquent de 0,26 unités SD dans l’IMC de la période 2. Signification Ces résultats suggèrent que les conséquences néfastes actuellement attribuées à l’obésité pourraient être attribuées à l’hyperinsulinémie (ou à un autre facteur immédiat). |
L’obésité est associée à un certain nombre de maladies chroniques non transmissibles (MNT), telles que le diabète de type 2, les maladies coronariennes, les maladies rénales chroniques et l’asthme. Bien que l’on suppose également que l’obésité est à l’origine d’un décès prématuré, cette association ne répond pas à plusieurs critères de causalité de Bradford Hill.
- Premièrement, le risque de décès attribuable est faible (<5 %).
- Deuxièmement, le gradient dose-réponse entre l’indice de masse corporelle (IMC) et la mortalité est en forme de U avec le surpoids (et éventuellement l’obésité de niveau I) comme minimum.
- Troisièmement, les preuves provenant de modèles animaux proviennent principalement de souris nourries avec un régime riche en graisses ; Contrairement aux humains, ces animaux ne consommaient généralement pas de graisse dans leur régime alimentaire habituel et, par conséquent, les expériences ne sont pas potentiellement analogues à celles réalisées chez les humains.
- Quatrièmement, les preuves selon lesquelles les personnes obèses vivent plus longtemps que leurs homologues maigres dans les populations souffrant de maladies aiguës ou chroniques et d’un âge avancé sont remarquablement cohérentes. Il est donc possible qu’au lieu d’être un facteur de risque de maladies non transmissibles, l’obésité soit en réalité un facteur de protection. réponse au développement de la maladie.
Les liens putatifs entre l’obésité et les effets indésirables sont souvent attribués à deux médiateurs potentiels : l’inflammation chronique et l’hyperinsulinémie.
Ces caractéristiques ont été associées à plusieurs MNT, notamment l’obésité, ainsi que le diabète de type 2, les maladies cardiovasculaires et les maladies rénales chroniques. Les données existantes sur l’association de l’obésité avec l’inflammation chronique et/ou l’hyperinsulinémie sont principalement transversales, ce qui rend difficile la confirmation de l’orientation d’une quelconque causalité.
Cette revue systématique et méta-analyse résume les preuves sur la temporalité de l’association entre un IMC plus élevé et une inflammation chronique et/ou une hyperinsulinémie. Nous avons émis l’hypothèse que les modifications de l’inflammation chronique et de l’hyperinsulinémie précéderaient les modifications de l’IMC plus élevé.
Importance
L’obésité est associée à un certain nombre de maladies chroniques non transmissibles et serait à l’origine de décès prématurés.
But
Résumer les preuves sur la temporalité de l’association entre un indice de masse corporelle (IMC) plus élevé et 2 médiateurs potentiels : l’inflammation chronique et l’hyperinsulinémie.
Nous avons effectué des recherches dans les sources de données MEDLINE (de 1946 au 20 août 2019) et Embase (de 1974 au 19 août 2019), bien que seules les études publiées en 2018 aient été incluses en raison du volume élevé de résultats. L’analyse des données a été réalisée entre janvier 2020 et octobre 2020.
Sélection d’études et de mesures
Des études longitudinales et des essais cliniques randomisés mesurant le niveau d’insuline à jeun et/ou un marqueur de l’inflammation et l’IMC avec au moins 3 points temporels proportionnels ont été sélectionnés.
Extraction et synthèse de données
Les pentes de ces marqueurs ont été calculées entre les points temporels et standardisées. Les pentes standardisées ont été méta-régressées au cours des périodes ultérieures (période 2) avec des pentes standardisées au cours des périodes antérieures (période 1). Les éléments fondés sur des preuves pouvant indiquer un risque de biais ont été évalués.
Résultats
À partir de 1 865 enregistrements, 60 études éligibles ont été identifiées avec 112 cohortes de 5 603 participants. La plupart des pentes standardisées étaient négatives, ce qui signifie que les participants à la plupart des études ont connu une diminution de leur IMC, de leur taux d’insuline à jeun et de leur taux de protéine C-réactive.
L’association entre le niveau d’insuline à jeun de la période 1 et l’IMC de la période 2 était positive et significative (β = 0,26 ; IC à 95 %, 0,13-0,38 ; I2 = 79 %) : pour chaque changement d’unité de l’écart-type dans le niveau d’insuline de la période 1, il y avait un changement associé ultérieur de 0,26 unités SD au cours de la période 2 de l’IMC.
L’association entre le niveau d’insuline à jeun de la période 1 et l’IMC de la période 2 est restée significative lorsque le niveau de protéine C-réactive de la période 1 a été ajouté au modèle (β = 0,57 ; IC à 95 %, 0,27 à 0,86).
Dans ce modèle bivarié, le niveau de protéine C-réactive de la période 1 n’était pas associé de manière significative à l’IMC de la période 2 (β = –0,07 ; IC à 95 %, –0,42 à 0,29 ; I2 = 81 %).
Graphique à bulles des associations temporelles entre les changements de la période 1 et de la période 2
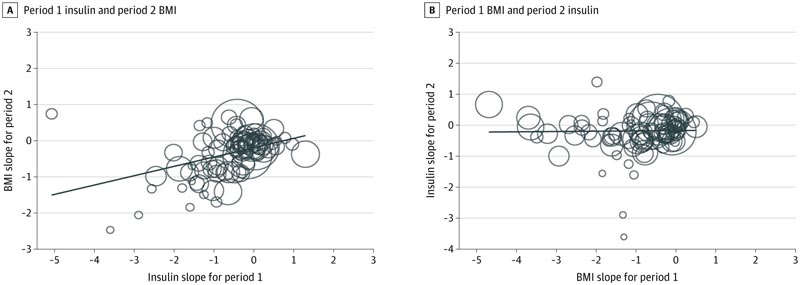
A, la variation de la période 2 de l’indice de masse corporelle (IMC) (ou pente standardisée) est régressée vers la variation de l’insuline de la période 1. B, le changement d’insuline au cours de la période 2 régresse par rapport au changement d’IMC au cours de la période 1. La ligne de tendance plate dans le panneau B suggère qu’il n’y a aucune association entre le changement d’IMC de la période 1 et le changement d’insuline de la période 2. La diagonale La ligne de tendance du panneau A soutient une association temporelle positive entre la modification de l’insuline de la période 1 et la modification de l’IMC de la période 2. La taille des cercles est basée sur l’inverse de l’ES de chaque cohorte.
Conclusions et pertinence Dans cette méta-analyse, les résultats du séquençage temporel (dans lesquels les changements du niveau d’insuline à jeun précèdent les changements de poids) ne sont pas cohérents avec l’affirmation selon laquelle l’obésité provoque des maladies chroniques non transmissibles et des décès prématurés en augmentant les niveaux d’insuline à jeun. |
Discussion
Cette revue systématique et cette méta-analyse suggèrent que les diminutions de l’insuline à jeun sont plus susceptibles de précéder une diminution du poids que les diminutions de poids ne précèdent la diminution des niveaux d’insuline à jeun.
Après avoir pris en compte l’association entre les niveaux d’insuline à jeun antérieurs et la probabilité ultérieure de prise de poids, il n’y avait aucune preuve que l’inflammation précédait la prise de poids ultérieure.
Cette séquence temporelle (dans laquelle les changements de l’insuline à jeun précèdent les changements de poids) n’est pas cohérente avec l’affirmation selon laquelle l’obésité provoque des maladies non transmissibles et des décès prématurés en augmentant les niveaux d’insuline à jeun.
Soutien d’autres études
Chez les patients atteints de diabète de type 2, des ECR ont montré que l’introduction d’insuline et de sulfonylurées exogènes (qui augmentent la production d’insuline endogène) par rapport à des doses plus faibles ou à l’absence de traitement médicamenteux entraîne une prise de poids. Certains patients atteints de diabète de type 1 sautent ou réduisent délibérément leurs injections d’insuline. De même, les rapports faisant suite à une chirurgie bariatrique indiquent systématiquement que les taux d’insuline diminuent avant le poids chez les patients subissant une chirurgie bariatrique.
Par conséquent, la découverte selon laquelle les changements dans les niveaux d’insuline ont tendance à précéder les changements de poids et non l’inverse a été démontrée précédemment dans 3 scénarios différents. À notre connaissance, il n’existe aucune preuve clinique démontrant que la prise ou la perte de poids précède une augmentation ou une diminution de l’insuline endogène.
Importance des résultats
L’obésité en tant que cause de décès prématuré ne répond pas à plusieurs des critères de causalité de Bradford Hill : la force de l’association est faible ; la constance de l’effet chez les populations âgées et/ou malades favorise l’obésité ; et le gradient biologique est en forme de U, le surpoids et l’obésité de niveau 1 étant associés au risque le plus faible ; et si l’hyperinsulinémie est considérée comme le médiateur, alors la séquence temporelle est incorrecte.
La résistance à l’insuline , cause et conséquence de l’hyperinsulinémie, conduit au diabète de type 2 et est associée à d’autres effets indésirables, tels que l’infarctus du myocarde, les maladies pulmonaires chroniques et certains cancers, et peut également être impliquée dans la néphropathie diabétique.
Malgré les 3 scénarios décrits ci-dessus, il est communément admis que l’obésité conduit à une hyperinsulinémie. Si l’inverse est vrai et que l’hyperinsulinémie conduit réellement à l’obésité et à ses conséquences indésirables potentielles, alors la perte de poids sans diminution concomitante de l’insuline (par exemple, liposuccion) ne devrait pas remédier à ces conséquences indésirables. De plus, la perte de poids ne réduirait pas le risque chez les personnes souffrant d’obésité dite métaboliquement saine, c’est-à-dire celles qui ne présentent pas de résistance à l’insuline.
Il est intéressant de noter que la résistance à l’insuline est également présente chez les personnes minces , notamment les hommes et les personnes d’origine asiatique. Ces 2 groupes présentent un risque plus élevé de diabète de type 2 et de maladies cardiovasculaires, mais sont plus susceptibles d’être minces que les femmes et les personnes d’origine non asiatique.
Ces observations concordent avec l’hypothèse selon laquelle l’hyperinsulinémie, plutôt que l’obésité, est à l’origine d’effets indésirables dans cette population.
| Nous pensons que la capacité à stocker les sous-produits de l’excès de glucose en augmentant la taille des cellules adipeuses (ce qui se manifeste par l’obésité) pourrait retarder l’apparition du diabète de type 2 et ses conséquences chez certains individus, expliquant ainsi le soi-disant paradoxe de l’obésité. une mortalité plus faible. chez les personnes obèses. Cette idée, même si elle n’est pas nouvelle, correspond mieux aux preuves émergentes. |
Si cette spéculation est exacte, évaluer la capacité de stocker de tels sous-produits au niveau individuel pourrait constituer une étape utile vers une médecine personnalisée.
Bien que l’hyperinsulinémie en soi ne soit pas l’agent causal conduisant à des résultats indésirables (mais plutôt un marqueur d’un autre facteur plus proximal), cela ne changerait rien au manque de soutien en faveur de la recommandation d’une perte de poids chez les personnes obèses. Il faudrait plutôt étudier d’autres marqueurs qui, bien que corrélés à l’obésité, sont plus fortement associés à la mortalité prématurée car ils existent également chez les individus maigres.
Les thérapies qui réduisent les niveaux d’insuline (par exemple, un régime modéré avec moins de glucides simples et de metformine) peuvent être durables si un marqueur intermédiaire autre que le poids est recherché.
Alors que la prévalence de l’obésité continue d’augmenter dans le monde, des études supplémentaires sont nécessaires de toute urgence pour confirmer cette hypothèse, d’autant plus que les campagnes de santé publique promouvant la perte de poids sont inefficaces et conduisent à une stigmatisation100 parmi les personnes obèses. obésité.
Limites
Cette étude a des limites. Premièrement, les études identifiées recrutaient en grande partie des participants souffrant d’obésité chronique subissant des interventions de perte de poids et les mesures d’intérêt (par exemple, le poids, le niveau d’insuline et le niveau de CRP) diminuaient pour la plupart. Les résultats se limitent aux personnes qui perdent du poids et, compte tenu des résultats de l’analyse du sous-groupe bariatrique, sont probablement dus à une diminution rapide des taux d’insuline circulante.
Deuxièmement, les populations incluses présentaient pour la plupart des taux moyens de CRP de base compris entre 1 et 10 mg/L, ce qui suggère un faible degré d’inflammation chronique normalement associée à l’athérosclérose et à la résistance à l’insuline. Plusieurs études90,101-104 ont mis en évidence un groupe de personnes caractérisé par des taux de CRP systématiquement supérieurs à 10 mg/L. Bien que ce degré plus élevé d’inflammation chronique soit associé à l’obésité, peu de participants présentaient une résistance à l’insuline, ce qui suggère un groupe différent.
Troisièmement, cette méta-analyse a utilisé des données récapitulatives plutôt que des données individuelles sur les patients et est donc vulnérable aux erreurs. Une étude de cohorte prospective conçue pour la perte ou le gain de poids avec des mesures très fréquentes dans une population diversifiée fournirait une forme de preuve plus solide.
Quatrièmement, l’examen s’est limité aux études publiées en 2018, et de nombreuses études indiquent un risque important de biais par rapport à leurs objectifs déclarés. Cependant, aucune des deux études n’a été conçue pour mesurer les associations temporelles entre les mesures d’intérêt, de sorte que ces limitations dans la conduite de l’étude n’auraient pas nécessairement conduit à un biais en ce qui concerne les résultats. Bien que la recherche ait été limitée à une seule année de publication (2018) afin de réduire la charge de travail associée à cette revue, il n’y a aucune raison de s’attendre à ce que les données de cette année diffèrent des données publiées avant ou après.
Conclusions
|
















