Arrière-plan
Le nitazoxanide est largement disponible et exerce une activité antivirale à large spectre in vitro. Cependant, il n’existe aucune preuve de son impact sur l’infection par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2).
Méthodes
Dans un essai multicentrique, randomisé, en double aveugle et contrôlé par placebo, des patients adultes présentant jusqu’à 3 jours après l’apparition des symptômes de la maladie à coronavirus 2019 (COVID-19) (toux sèche, fièvre et/ou fatigue) ont été recrutés.
Après confirmation de l’infection par le SRAS-CoV-2 par PCR transcriptase inverse sur un écouvillon nasopharyngé, les patients ont été randomisés selon un rapport 1:1 pour recevoir du nitazoxanide (500 mg) ou un placebo, trois fois par jour, pendant 5 jours.
Le critère de jugement principal était la résolution complète des symptômes. Les critères de jugement secondaires étaient la charge virale, les tests de laboratoire, les biomarqueurs sériques de l’inflammation et le taux d’hospitalisation. Les événements indésirables ont également été évalués.
Résultats
Du 8 juin au 20 août 2020, 1 575 patients ont été examinés. Parmi ceux-ci, 392 ont été analysés (198 placebo, 194 nitazoxanide). Le délai médian (intervalle interquartile) entre l’apparition des symptômes et la première dose du médicament à l’étude était de 5 (4-5) jours.
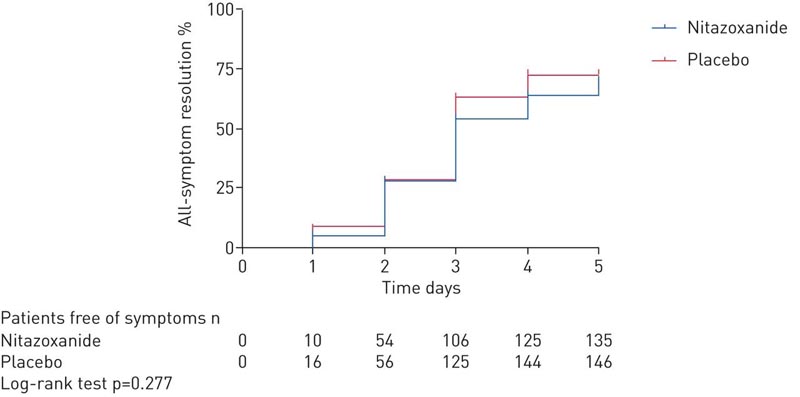
Lors de la visite d’étude de 5 jours, la résolution des symptômes ne différait pas entre les bras nitazoxanide et placebo.
Les écouvillons collectés étaient négatifs pour le SRAS-CoV-2 chez 29,9 % des patients du groupe nitazoxanide contre 18,2 % dans le groupe placebo (p = 0,009).
La charge virale a été réduite après le nitazoxanide par rapport au placebo (p = 0,006).
Le pourcentage de réduction de la charge virale entre le début et la fin du traitement était plus élevé avec le nitazoxanide (55 %) qu’avec le placebo (45 %) (p = 0,013).
Les autres critères de jugement secondaires n’étaient pas significativement différents. Aucun événement indésirable grave n’a été observé.
Discussion
Dans cet essai multicentrique, en double aveugle, randomisé et contrôlé par placebo portant sur des patients atteints d’une forme légère de COVID-19, nous avons constaté que la résolution des symptômes (toux sèche, fièvre et fatigue) ne différait pas entre le nitazoxanide et le placebo après 5 jours de traitement.
Le nitazoxanide était sûr, réduisait considérablement la charge virale et augmentait la proportion de patients testés négatifs pour le SRAS-CoV-2 après 5 jours de traitement par rapport au placebo. Le nitazoxanide n’a pas empêché l’hospitalisation ni provoqué de modification de la formule sanguine complète, des taux de CRP ou des biomarqueurs sériques de l’inflammation. De plus, le nitazoxanide est peu coûteux, largement disponible et, à ce jour, il n’a pas été démontré que les autres thérapies recommandées apportent un quelconque bénéfice dans cette population.
Il existe un besoin urgent de médicaments pharmacothérapeutiques fondés sur des données probantes pour lutter contre le COVID-19. Dans le contexte difficile d’une pandémie, la réutilisation des médicaments peut réduire le long processus de développement de médicaments et permettre le déploiement rapide de thérapies efficaces auprès de la population.
Avant la mise en œuvre de cet essai, la bibliothèque des National Institutes of Health Clinical Collection, une collection de 727 médicaments ou composés apparentés approuvés par la Food and Drug Administration (FDA) des États-Unis et ayant des antécédents d’utilisation dans des essais cliniques sur l’homme, a été examinée pour activité antivirale in vitro contre le SRAS-CoV-2 (Figure supplémentaire S1). Le nitazoxanide et le tizoxanide, son métabolite actif, ont réduit de manière significative la charge virale dans les cellules Vero E6, du rein embryonnaire humain (HEK 293T) et de l’épithélium pulmonaire (Calu-3) infectés par le SRAS-CoV-2, sans induire de perte de viabilité cellulaire.
Le profil d’effets indésirables du nitazoxanide est bien connu, car il est disponible dans le commerce et utilisé en clinique depuis 1996 ; en fait, une formulation commerciale a été utilisée dans cet essai. Un schéma posologique de 500 mg toutes les 12 heures est approuvé et couramment prescrit pour le traitement de la parasitose intestinale, avec peu d’effets indésirables signalés.
Dans notre étude, la même dose a été administrée, mais toutes les 8 heures, sur la base des études pharmacologiques in vitro de notre groupe et des données publiées sur la concentration plasmatique, afin de maximiser l’inhibition potentielle du SRAS-CoV-2 in vivo. Nous avons supposé que des ratios élevés entre la concentration sérique maximale à des doses sûres chez l’homme et la concentration antivirale efficace maximale in vitro se traduiraient par un plus grand potentiel de suppression virale aux doses approuvées.
Le nitazoxanide n’a pas atteint le résultat principal chez les patients atteints d’une forme légère de COVID-19 lorsqu’il a été évalué après 5 jours de traitement. Conformément aux données in vitro, nous avons observé des réductions significatives de la charge virale après une cure de 5 jours de nitazoxanide chez les patients atteints d’une forme légère de COVID-19. Cet effet peut avoir un impact épidémiologique, réduisant potentiellement la propagation communautaire du SRAS-CoV-2, ainsi que la morbidité et la mortalité.
Conclusions Chez les patients atteints de COVID-19 léger, la résolution des symptômes ne différait pas entre les groupes nitazoxanide et placebo après 5 jours de traitement. Cependant, un traitement précoce par le nitazoxanide s’est avéré sûr et a considérablement réduit la charge virale. |