Les éosinophiles sont des leucocytes multifonctionnels, constituants normaux du tractus gastro-intestinal, sauf lorsqu’ils sont présents dans l’épithélium pavimenteux de l’œsophage.
Les éosinophiles homéostatiques résident principalement dans la lamina propria de l’intestin grêle et protègent contre les parasites et les bactéries pathogènes. Ces cellules sont sélectives dans leur réponse aux parasites, permettant à certains de résider dans la muqueuse, régulant ainsi le microbiome intestinal et participant à l’homéostasie tissulaire.
Les éosinophiles modulent également la réponse immunitaire, via la sécrétion de cytokines qui peuvent activer les cellules dendritiques et induire un changement de classe IgA dans les cellules B. Dans leur rôle homéostatique, les éosinophiles sont répartis uniformément et de manière clairsemée dans la lamina propria et ne forment pas d’amas ni ne subissent de dégranulation.
Dans l’intestin grêle, les éosinophiles maintiennent les concentrations d’IgA grâce à des facteurs de sécrétion qui prolongent la survie des plasmocytes sécrétant des IgA et induisent la production d’IgA sécrétoires.
Cette immunoglobuline constitue une importante défense de première ligne de la muqueuse, empêchant l’invasion de micro-organismes pathogènes en les recouvrant d’une enveloppe hydrophile repoussée par l’épithélium muqueux, permettant ainsi leur expulsion.
L’éosinophilie tissulaire et périphérique est connue depuis longtemps comme une preuve d’invasion parasitaire, et comme tout pathologiste le sait, lorsque les éosinophiles prédominent dans la muqueuse gastro-intestinale, il est bon de garder à l’esprit le principe « voir les éosinophiles, penser aux parasites ».
Sa présence excessive n’est pas bénéfique, comme dans l’asthme et les troubles gastro-intestinaux à éosinophiles, dans lesquels le recrutement d’éosinophiles est induit par des agents pathogènes ou des allergènes, provoquant des lésions épithéliales.
Dans l’asthme, les phénotypes des différentes maladies sont clairs et la manifestation de la maladie ne dépend pas seulement d’une relation directe avec le nombre d’éosinophiles, mais aussi de l’interaction entre la prédisposition génétique et le microbiome.
Cette interaction est moins connue dans les troubles éosinophiles du tractus gastro-intestinal, à l’exception de l’œsophagite à éosinophiles, caractérisée par une éosinophilie au niveau de la muqueuse squameuse, dans laquelle une interaction similaire entre la génétique, le microbiome et les allergènes (notamment alimentaires) a été prouvée.
Les troubles éosinophiles primaires comprennent l’œsophagite à éosinophiles, la gastro-entérite et la colite. Une atteinte gastro-intestinale peut également être observée dans le syndrome hyperéosinophile.
Les causes secondaires de l’éosinophilie gastro-intestinale sont nombreuses, notamment l’hypersensibilité alimentaire, les réactions médicamenteuses, les infestations parasitaires et les tumeurs malignes, qui sont plus fréquentes que les maladies éosinophiles primaires.
D’autres maladies gastro-intestinales sont également caractérisées par un nombre accru d’éosinophiles, telles que le reflux gastro-œsophagien et les maladies inflammatoires de l’intestin.
Classification des troubles gastro-intestinaux associés aux éosinophiles Maladies éosinophiles primaires. • Œsophagite à éosinophiles "Infiltration éosinophile secondaire dans la maladie" . • Infection : par exemple, infection parasitaire ou à Helicobacter pylori. Maladies gastro-intestinales associées à une augmentation des éosinophiles • Dyspepsie fonctionnelle. |
Cette revue se concentre sur les troubles gastro-intestinaux éosinophiles moins étudiés, tels que la gastro-entérite et la colite, ainsi que sur l’éosinophilie duodénale plus récemment décrite, liée à la dyspepsie fonctionnelle, et la colite focale à éosinophiles liée à la spirochétose colique.
Tous ces troubles gastro-intestinaux éosinophiles sont caractérisés par un excès d’éosinophiles dans la muqueuse, la sous-muqueuse ou la musculeuse de l’estomac, de l’intestin grêle ou du côlon ; sa cause est souvent inconnue. Le syndrome hyperéosinophile avec atteinte gastro-intestinale est également brièvement décrit.
| Gastro-entérite à éosinophiles et colite à éosinophiles |
> Épidémiologie
L’examen d’une base de données basée sur la population américaine portant sur plus de 35 millions d’enfants et d’adultes a révélé une prévalence globale de gastro-entérite à éosinophiles de 5,1/100 000 et de colite à éosinophiles de 2,1/100 000 personnes. Toutefois, dans d’autres études, la prévalence était presque le double. La gastro-entérite à éosinophiles est un peu plus répandue chez les enfants, tandis que la colite à éosinophiles est plus fréquente chez les adultes.
Ces troubles prédominent au cours des troisième et quatrième décennies de la vie. Aux États-Unis, une prévalence plus élevée a été observée dans les États du nord et dans les zones urbaines et suburbaines plus que dans les zones rurales. La prévalence est également légèrement plus élevée chez les femmes et les individus blancs, et la plupart des patients atteints de gastro-entérite à éosinophiles ont un niveau d’éducation relativement élevé.
Il est à noter que la gastro-entérite et la colite à éosinophiles sont associées à des maladies allergiques et que les patients souffrent souvent d’allergies médicamenteuses concomitantes, de rhinite, d’asthme, de sinusite, de dermatite, d’allergies alimentaires, d’eczéma ou d’urticaire.
Il a été prouvé qu’il existe des cas de maladies du tissu conjonctif auto-immunes chez les patients atteints de gastro-entérite à éosinophiles. Il existe des rapports faisant état de 19 cas publiés qui montrent une association entre les deux.
| Chez 35 % de ces patients, une association a été trouvée avec le lupus érythémateux disséminé, 20 % avec la polyarthrite rhumatoïde, 15 % avec la sclérose systémique et 15 % avec la myosite inflammatoire. |
> Physiopathologie
La pathogenèse de l’éosinophilie présente dans la gastro-entérite à éosinophiles et la colite est peu étudiée. L’histopathologie est caractérisée par un nombre excessif d’éosinophiles avec des signes de dégranulation.
On sait que dans l’œsophagite à éosinophiles, les allergènes alimentaires entraînent l’infiltration des éosinophiles, puisque leur élimination de l’alimentation constitue une thérapie efficace ; 74 % des individus ayant suivi un régime dans lequel 6 aliments ont été éliminés ont montré une amélioration des symptômes et de la résolution histologique.
L’association de l’allergie et de l’atopie dans la gastro-entérite à éosinophiles et la colite à éosinophiles suggère que chez certaines personnes, d’autres allergènes pourraient également en être responsables, puisque la moitié des patients atteints de gastrite à éosinophiles ont montré une positivité aux tests de sensibilité cutanée aux allergènes alimentaires ou aéroallergènes. , avec une augmentation du nombre d’éosinophiles dans le sang.
Un transcriptome gastrique, comprenant une immunité de type T auxiliaire pilotée par les interleukines 4, 5 et 13, a été observé chez des patients atteints de gastro-entérite à éosinophiles et une expression accrue de gènes impliqués dans des voies opératoires potentielles.
Les auteurs soutiennent qu’il est important de souligner que ce transcriptome avait une corrélation de plus de 90 % avec l’œsophagite à éosinophiles, ce qui suggère que des traitements similaires pourraient être efficaces pour les deux affections.
Cependant, certains patients atteints de troubles gastro-intestinaux à éosinophiles ont une composante auto-immune commune sans atopie, ce qui pourrait conduire à l’éosinophilie par différentes voies immunologiques, indiquant la complexité de cette maladie.
La dysbiose gastro-intestinale pourrait également jouer un rôle dans la physiopathologie de ces troubles. Des altérations du microbiote intestinal ont été impliquées dans l’allergie, mais on ne sait pas s’il s’agit d’une cause ou d’une conséquence de la maladie.
La combinaison d’une prédisposition génétique, d’une dysbiose et d’un environnement (par exemple, allergènes ingérés ou inhalés) ouvre probablement la voie à l’éosinophilie dans la colite à éosinophiles et la gastro-entérite, mais des recherches supplémentaires sont nécessaires pour déterminer la pathogenèse sous-jacente de ces troubles. complexe.
| Présentation clinique |
Les patients atteints de gastro-entérite à éosinophiles et de colite à éosinophiles présentent généralement des symptômes gastro-intestinaux non spécifiques, avec un taux d’éosinophiles sanguins qui peut être normal.
Certaines études rapportent que la majorité des patients (80 %) présentent au moins une légère éosinophilie périphérique.
La gastroentérite et la colite à éosinophiles sont souvent associées à des symptômes œsophagiens de reflux, de dysphagie et à d’autres symptômes vagues, notamment des douleurs abdominales, des nausées, des vomissements, un retard de croissance, de la diarrhée et une perte de poids. Des pathologies plus graves ont également été observées : ascite, volvulus, invagination, perforation et obstruction.
La présentation clinique dépend probablement de la localisation, de l’étendue et de la profondeur de la maladie dans le tractus gastro-intestinal. Les patients présentant une atteinte éosinophile plus étendue, au-delà de la muqueuse, dans la musculeuse, peuvent présenter une obstruction tandis que ceux présentant une atteinte séreuse peuvent présenter une ascite.
Bien qu’une éosinophilie œsophagienne et une œsophagite à éosinophiles diagnostiquée aient été observées chez des enfants atteints de gastro-entérite à éosinophiles, il n’y a qu’un seul cas signalé chez les adultes. Parmi 30 enfants atteints de gastrite à éosinophiles, 28 ont subi des biopsies œsophagiennes simultanées. Douze (43 %) présentaient une œsophagite à éosinophiles concomitante (≥15 éosinophiles/champ de puissance élevée). Aucun patient n’avait de colite à éosinophiles concomitante, bien que seulement 7 (23 %) aient subi des biopsies du côlon.
| Diagnostic |
Une gastro-entérite à éosinophiles et une colite à éosinophiles peuvent être suspectées lors d’une étude endoscopique, et l’imagerie peut être utile pour juger de l’étendue de la maladie, mais une biopsie est nécessaire pour confirmer le diagnostic.
Endoscopie, imagerie et histopathologie.
Chez les patients atteints de gastro-entérite à éosinophiles, les résultats endoscopiques peuvent sembler normaux ou présenter : un érythème, des taches blanches, des érosions focales, des ulcérations, un épaississement des plis, des polypes, des nodules et une friabilité.
Chez 15 patients, les résultats endoscopiques étaient largement non spécifiques : la plupart présentaient un érythème, mais 2 patients présentaient des ulcères dans l’antre duodénal.
Dans la colite à éosinophiles, la coloscopie peut révéler des plaques d’œdème muqueux, un érythème ponctué, des lésions blanchâtres en relief, une muqueuse granuleuse pâle et une ulcération aphteuse, bien que ces résultats soient rares et peu fiables.
Concernant les images, l’implication muqueuse dans la gastro-entérite à éosinophiles peut être mise en évidence par la présence d’un épaississement des plis, de polypes et d’ulcères en tomodensitométrie (TDM).
Dans la maladie avec atteinte de la couche musculaire, on peut observer une distensibilité réduite, une sténose et un épaississement des plis. Si la séreuse est atteinte, il peut y avoir une ascite, un épaississement omental et une lymphadénopathie.
Les images de colite à éosinophiles chez l’adulte et l’enfant n’ont été décrites que dans des rapports de cas et de petites séries. Les caractéristiques chez ces patients sont la présence du signe « patte d’araignée » généré par un épaississement diffus de la muqueuse ; Ce signe apparaît lorsque le contraste pénètre nettement dans les sinus muqueux, dans la coupe longitudinale de l’intestin au scanner. En cas d’atteinte muqueuse, un épaississement concentrique du côlon et de l’ascite a été observé.
Dans la plus grande série d’enfants atteints de colite à éosinophiles et d’observations radiologiques publiées à ce jour, un côlon anormal a été noté chez 6 patients sur 7, avec un épaississement pariétal, austral (isolé) et circonférentiel.
L’histologie des biopsies de la muqueuse gastro-intestinale est la référence en matière de diagnostic de la gastro-entérite à éosinophiles et de la colite à éosinophiles, et le principal critère de diagnostic est l’excès d’éosinophilie de la muqueuse en l’absence de cause connue.
Cependant, le nombre d’éosinophiles nécessaire pour poser un diagnostic n’est pas aussi bien défini que dans l’œsophagite à éosinophiles (15 éosinophiles/champ de puissance élevée).
Dans une revue récente, 30 éosinophiles/champ de forte puissance était un nombre considéré comme raisonnable pour poser le diagnostic de gastrite à éosinophiles, tandis qu’un nombre > 50 éosinophiles/champ de forte puissance dans le côlon droit a été suggéré pour le diagnostic de colite à éosinophiles, > 35. éosinophiles/champ de forte puissance dans le côlon transverse ou 25/champ de forte puissance dans le côlon gauche. (tableau).
Pour le diagnostic, des numérations plus élevées ont également été proposées, ainsi que d’autres caractéristiques histologiques, mais ce ne sont que des suggestions dérivées de séries de cas et jusqu’à présent, elles n’ont pas été validées dans différentes populations, comme c’est le cas de l’œsophagite à éosinophiles. Il n’existe actuellement aucune directive formelle pour le diagnostic de la biopsie muqueuse.
Il convient de garder à l’esprit que les éosinophiles sont des constituants normaux de l’intestin et que leur nombre peut varier considérablement d’un individu à l’autre, en fonction de la région, du climat, de l’âge, de l’exposition aux allergènes alimentaires et aux agents infectieux.
Lors de l’évaluation des échantillons de biopsie, ces facteurs doivent être pris en compte. Ces facteurs peuvent soulever des doutes sur le diagnostic, ce qui signifie que certains cas pourraient passer inaperçus à moins que les éosinophiles ne soient systématiquement comptés dans toutes les biopsies.
La gastro-entérite à éosinophiles a été initialement classée en 1970 selon le site d’infiltration des éosinophiles : muqueux, musculaire ou séreux.
Une étude réalisée en 1990 auprès de 40 patients atteints de gastroentérite à éosinophiles a montré que 23 d’entre eux présentaient une maladie des muqueuses, 12 avaient une atteinte de la couche musculaire et 5 de la couche sous-séreuse. Un examen ultérieur a clairement indiqué qu’un passage de l’atteinte musculaire à l’atteinte muqueuse s’était produit.
Dans cette étude, 52 patients présentaient une maladie de la muqueuse, 3 une maladie de la couche musculaire et 4 une maladie sous-séreuse. Bien que ce changement puisse constituer un critère de diagnostic endoscopique, il est probable que les cas puissent désormais être diagnostiqués plus tôt que la série initiale, en réalisant une biopsie de la muqueuse superficielle au lieu de la biopsie traditionnelle de pleine épaisseur, avec pour conséquence une réduction de la progression. de la couche musculaire à la couche séreuse, secondaire à un traitement efficace, par rapport aux rapports précédents.
L’ histopathologie de la muqueuse dans la gastro-entérite originale et la colite à éosinophiles est similaire et est décrite comme un excès d’éosinophiles dans la lamina propria, avec dégranulation et infiltration possible de l’épithélium superficiel et des cryptes, avec formation d’abcès superficiels et cryptiques.
L’épithélium pourrait présenter des modifications dégénératives et régénératives, avec une hyperplasie fovéolaire et cryptée. On observe souvent un excès considérable d’éosinophiles disposés en feuillets ou en groupes.
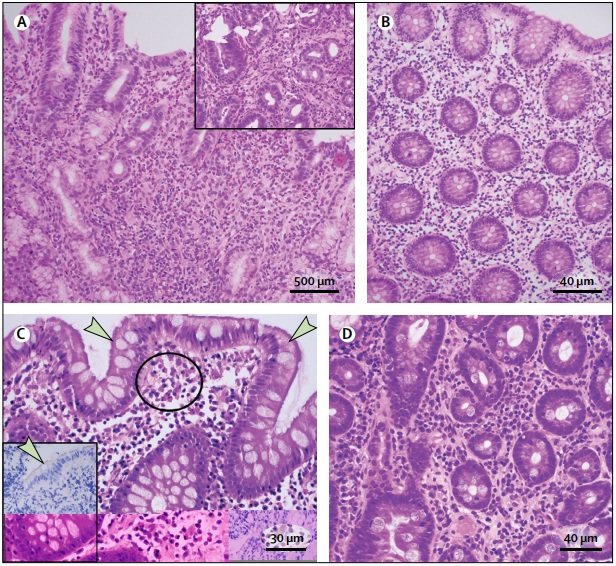
(A) Gastrite éosinophile avec des feuilles de > 30 éosinophiles par champ de haute puissance (HPF) dans la lamina propria, regroupées autour des glandes (encadré). (B) Colite à éosinophiles, biopsie du côlon gauche, avec > 35 éosinophiles par HPF dans la lamina propria. (C) Spirochétose colique, une brume bleue sur la coloration à l’hématoxyline et à l’éosine adhérant à la surface de l’épithélium colique (indiquée par des flèches), avec des amas d’éosinophiles dans la lamina propria (cercle) ; l’encadré montre l’immunohistochimie pour identifier les spirochètes de surface (indiqués par la flèche). (D) Éosinophilie duodénale chez un patient présentant une dyspepsie fonctionnelle de type détresse postprandiale avec 36 éosinophiles pour 5 HPF dans la lamina propria
Un dépôt important de protéine basique majeure des granules d’éosinophiles extracellulaires, détecté par immunohistochimie, est révélateur d’une dégranulation des éosinophiles et a été observé plus fréquemment chez les patients atteints de gastro-entérite à éosinophiles que chez les témoins sains.
La dégranulation peut masquer le nombre d’éosinophiles, comme cela se produit dans l’œsophagite à éosinophiles, dans laquelle le nombre d’éosinophiles trouvés dans l’épithélium pavimenteux était significativement plus élevé avec l’immunocoloration des protéines basiques majeures qu’avec l’hématoxyline-éosine .
> Sites de biopsie pour gastro-entérite à éosinophiles
Le choix des sites de biopsie endoscopique intestinale est important lorsque le diagnostic est incertain, notamment celui de la gastro-entérite à éosinophiles et de la colite à éosinophiles. La pathologie peut être irrégulière et, par conséquent, afin de confirmer le diagnostic, il est conseillé de prélever des biopsies dans toutes les régions de l’intestin, y compris les lésions macroscopiques évidentes.
La bonne pratique consiste à s’appuyer sur le système Sydney pour les sites de biopsie recommandés du corps gastrique, de l’antre et de l’incisura ; Les auteurs recommandent qu’au moins 4 échantillons de biopsie soient prélevés dans la première et la deuxième partie du duodénum, comme pour le diagnostic de la maladie cœliaque en cas de maladie inégale, en plaçant les échantillons dans des récipients séparés.
Si une gastro-entérite à éosinophiles est suspectée chez des patients pédiatriques, il est également recommandé de réaliser des biopsies de l’œsophage, du corps gastrique, de la muqueuse antrale et du duodénum.
Pour le diagnostic de la colite à éosinophiles non associée à des lésions macroscopiquement visibles, les mêmes critères peuvent être appliqués que pour les maladies inflammatoires de l’intestin, aussi bien chez l’adulte que chez l’enfant, avec des performances optimales lorsque les échantillons sont prélevés sur plusieurs sites, offrant une plus grande précision. diagnostic et un meilleur accord diagnostique inter-observateur.
Par conséquent, dans ces cas, les auteurs recommandent d’obtenir des échantillons de biopsie aléatoires de l’iléon terminal et de chaque segment colique du côlon (du caecum au rectum), en plaçant les échantillons dans des récipients séparés.
> Diagnostics différentiels
Bien qu’il ait été démontré que la gastro-entérite et la colite à éosinophiles sont associées à d’autres maladies, notamment aux allergies , la pathogenèse exacte est inconnue.
Par conséquent, ces maladies sont diagnostiquées par exclusion, car un nombre excessif d’éosinophiles dans l’intestin peut être observé dans de nombreuses conditions nécessitant une investigation clinicopathologique. En cas d’éosinophilie, il faut suspecter une infection.
Les infections les plus connues provoquant l’éosinophilie sont les infections parasitaires. Les antécédents de voyage et l’examen parasitologique des selles à la recherche d’œufs et de parasites sont une bonne pratique si la biopsie montre une éosinophilie. Des rapports récents de patients atteints de spirochétose colique associée à un syndrome du côlon irritable sans constipation ont montré une éosinophilie caractéristique à la biopsie colique, avec des amas adjacents de spirochètes dans l’épithélium superficiel du côlon.
Il a été constaté que dans la population générale subissant une coloscopie, 2,3 % souffraient de spirochétose colique à éosinophiles . Les comptes étaient plus élevés chez les patients atteints de spirochétose colique que chez ceux sans spirochétose, même dans le rectum.
Les personnes atteintes de spirochétose colique sont plus susceptibles de souffrir du syndrome inflammatoire de l’intestin que celles qui n’en souffrent pas. Une diarrhée est survenue chez 62 % des patients, contre 31 % des témoins, et des douleurs abdominales chez 52 %, contre 17 % des témoins.
L’éosinophilie gastrique peut être associée à une infection à Helicobacter pylori , avant et après le traitement d’éradication. L’hypersensibilité médicamenteuse peut également déclencher l’éosinophilie ; par exemple, le mycophénolate et les anti-inflammatoires non stéroïdiens. Cependant, comme ils sont couramment utilisés, ils doivent toujours être pris en compte dans le diagnostic différentiel.
Dans l’hypersensibilité alimentaire comme dans la proctocolite allergique, il existe une prévalence variée chez tous les bébés en bonne santé d’une réaction indésirable aux protéines du lait de vache, allant de 0,3 % à 7,5 %. Dans une étude prospective, 14 des 22 nourrissons (64 %) présentant un saignement rectal souffraient de colite allergique (définie par le nombre ou la localisation des éosinophiles), 5 (23 %) avaient des biopsies normales et 3 (13 %) souffraient de colite non spécifique.
Les saignements rectaux chez tous les nourrissons présentant des biopsies normales ou une colite non spécifique se sont résolus sans modification du régime alimentaire, à l’exception d’un nourrisson chez qui une maladie inflammatoire de l’intestin infantile a ensuite été diagnostiquée.
Les biopsies de la muqueuse rectale dans la proctocolite allergique sont caractérisées par une augmentation du nombre d’éosinophiles dans la lamina propria, l’épithélium superficiel et les cryptes, ainsi que dans la muqueuse musculaire, sans modifications architecturales significatives.
Généralement, ce diagnostic est clinique et les symptômes disparaissent 2 à 3 jours après l’élimination des protéines du lait de vache. Les biopsies du côlon de patients souffrant d’allergies alimentaires (une large gamme d’aliments) montrent une augmentation des éosinophiles coliques, avec dégranulation.
Une augmentation des éosinophiles duodénaux a été décrite dans la maladie coeliaque active. Plus récemment, une infiltration importante d’éosinophiles (jusqu’à 50 éosinophiles/champ de puissance élevée) a été démontrée chez 150 patients atteints de la maladie coeliaque. Il a été suggéré que les éosinophiles seraient impliqués dans les lésions des muqueuses puisqu’ils étaient découverts aux stades histologiques les plus avancés.
Les biopsies gastro-intestinales chez les patients atteints de maladies inflammatoires de l’intestin montrent des éosinophiles en nombre variable. Lorsque des éosinophiles sont détectés dans des biopsies gastriques, une maladie inflammatoire de l’intestin doit être suspectée, car les biopsies du côlon chez les patients atteints de la maladie de Crohn ou de colite ulcéreuse montrent également un plus grand nombre d’éosinophiles dans la lamina propria, par rapport aux témoins.
Une infiltration éosinophile du tractus gastro-intestinal a également été observée dans des troubles du tissu conjonctif, tels que la polyarthrite rhumatoïde, la sclérose systémique, la vascularite et la granulomatose éosinophile avec polyangéite.
| Dyspepsie fonctionnelle et éosinophilie duodénale |
L’éosinophilie a été décrite dans des biopsies duodénales de patients atteints de dyspepsie fonctionnelle, en particulier chez ceux présentant une satiété précoce, bien que le nombre d’éosinophiles soit inférieur à celui observé dans la gastro-entérite à éosinophiles.
Dans une étude suédoise, la dyspepsie fonctionnelle chez les individus présentant un nombre élevé d’éosinophiles en D1 (bulbe duodénal) (> 22 éosinophiles/5 champs de forte puissance) présentait un rapport de cotes de 11,7.
L’éosinophilie à J1 était associée de manière significative à une satiété précoce, impliquant une éosinophilie duodénale dans l’apparition de la détresse postprandiale, un sous-type de dyspepsie fonctionnelle, avec 52 éosinophiles/5 champs de forte puissance contre 34 éosinophiles/5 champs de forte puissance chez les témoins. Il a été démontré qu’une perturbation de la barrière intestinale et une altération de la fonction neuronale accompagnent l’éosinophilie duodénale dans les biopsies ex vivo de patients atteints de dyspepsie fonctionnelle.
Dans les biopsies ex vivo de patients atteints de dyspepsie fonctionnelle, une augmentation de la perméabilité duodénale (mesurée par la résistance électrique transépithéliale) et de la perméabilité paracellulaire a également été observée dans tout le duodénum avec éosinophilie et infiltration de mastocytes.
Chez ces patients, la signalisation neuronale, mesurée par les réponses calciques à la dépolarisation électrique et chimique, était altérée dans le plexus sous-muqueux, avec une corrélation négative significative entre la réponse calcique à la stimulation électrique et le nombre d’éosinophiles.
Il est possible que ces observations reflètent un mécanisme organique du trouble chez les patients atteints de dyspepsie fonctionnelle, par lequel un allergène ou une infection provoque l’interruption de la barrière et la génération d’une réponse immunitaire de type T-helper 2, qui induit le recrutement et l’éosinophile. dégranulation, qui à son tour affecte le système nerveux sous-muqueux et la fonction gastroduodénale. L’éosinophilie périphérique n’a pas été observée dans la dyspepsie fonctionnelle.
| Syndrome hyperéosinophile avec atteinte gastro-intestinale |
Actuellement, le syndrome hyperéosinophile est défini par un nombre absolu d’éosinophiles sanguins > 1 500 cellules/μl, pendant plus d’un mois (bien qu’en cas de lésions graves des organes cibles, le diagnostic puisse être posé immédiatement, pour éviter des retards thérapeutiques). .
Une hyperéosinophilie tissulaire accompagnée de lésions d’un organe cible médiées par les éosinophiles peut également être observée, mais toutes les causes connues d’hyperéosinophilie doivent être exclues avant de poser le diagnostic de syndrome hyperéosinophile.
Les causes secondaires de l’éosinophilie sanguine comprennent : les infections parasitaires ou virales, les maladies allergiques, les médicaments et produits chimiques, l’hyposurrénalisme et le cancer. Le syndrome hyperéosinophile est caractérisé par une infiltration multiorganique d’éosinophiles, par opposition à une atteinte d’un seul organe, comme c’est le cas dans les troubles gastro-intestinaux éosinophiles.
Il a été proposé que si des troubles gastro-intestinaux éosinophiles coexistent avec une hyperéosinophilie sanguine et qu’un seul organe est affecté, le terme syndrome de chevauchement hyperéosinophile peut être utilisé. L’atteinte organique dans ce syndrome peut inclure le syndrome chronique de Budd-Chiari, l’hépatite active, la cholangite à éosinophiles, la gastro-entérite à éosinophiles et la colite à éosinophiles, mais pas l’œsophagite à éosinophiles.
Il convient de noter que le trouble systémique des mastocytes, la mastocytose systémique, peut également se manifester par une éosinophilie intestinale, stimulée par la libération localisée de médiateurs chimiotactiques éosinophiles.
| Traitement de la gastro-entérite à éosinophiles et de la colite à éosinophiles |
Les causes secondaires, telles que les médicaments ou les infections parasitaires, doivent être soigneusement évaluées et traitées. S’il y a une carence en micronutriments, elle doit également être corrigée. La spirochétose colique, associée à une éosinophilie colique et à des symptômes gastro-intestinaux, peut être traitée par le métronidazole .
Il a été démontré que ce traitement améliore les symptômes gastro-intestinaux, même si des essais randomisés font défaut. En outre, les thérapies qui ont une certaine efficacité dans le traitement de la dyspepsie fonctionnelle avec éosinophilie duodénale comprennent les antagonistes des récepteurs des leucotriènes, le montélukast et les inhibiteurs de la pompe à protons (peut-être en raison de l’inhibition de la botaïne).
Cependant, il n’a pas été démontré que ces thérapies ou d’autres produisent une amélioration des symptômes de la dyspepsie fonctionnelle suite à la stabilisation ou à la réduction du nombre d’éosinophiles.
Si aucune cause secondaire d’éosinophilie n’est trouvée, le diagnostic de gastro-entérite à éosinophiles ou de colite à éosinophiles peut être posé, avec plusieurs options thérapeutiques, bien que les preuves de la plupart des thérapies se limitent à des rapports de cas et à de petites séries de cas non contrôlés.
| Thérapie diététique |
La thérapie diététique est recommandée comme traitement de première intention des troubles gastro-intestinaux éosinophiles.
Les régimes empiriques d’élimination des aliments, qui excluent les antigènes alimentaires couramment impliqués (lait, blé, soja, œufs, noix et fruits de mer), se sont révélés efficaces dans le traitement de l’œsophagite à éosinophiles, ce qui indique que l’alimentation est un déclencheur antigénique important dans le syndrome éosinophile prototypique. maladie.
Divers régimes d’élimination des aliments semblent efficaces dans la gastro-entérite à éosinophiles ; Cependant, les preuves se limitent à des rapports de cas et à de petites casuistiques. Dans cette étude, l’une des plus importantes, une série de cas rétrospectifs de 17 enfants atteints de gastro-entérite à éosinophiles, a montré un taux de réponse clinique à ce régime de 82 %.
Bien que certains rapports de cas décrivent des résultats positifs suite à l’élimination d’aliments spécifiques sur la base de tests d’allergie, il a été rapporté que la réponse au traitement a échoué dans les allergies alimentaires identifiées par des tests de sensibilité cutanée ou par la mesure des concentrations sériques d’IgE. spécifiques aux aliments, ce qui suggère que l’élimination sélective des aliments pourrait ne pas être efficace.
En fait, les tests d’allergie alimentaire spécifiques ne sont actuellement pas recommandés pour le traitement de la gastro-entérite à éosinophiles.
75 % des nourrissons nourris avec un régime élémentaire d’exclusion rigoureux ont également montré l’efficacité de ce régime pour le traitement de la gastro-entérite à éosinophiles et de la colite à éosinophiles ; cependant, l’observance du traitement chez les enfants plus âgés et les adultes limitera probablement considérablement son utilité.
| Corticostéroïdes |
Les corticostéroïdes sont utilisés comme traitement pharmacologique de première intention de la gastro-entérite à éosinophiles et de la colite à éosinophiles, lorsque le traitement diététique n’a pas obtenu de réponse clinique adéquate. Il a été démontré que la prednisone orale 20 à 40 mg/jour pendant 2 semaines induisait une rémission clinique chez la plupart des patients, bien que certains rapports recommandent des doses plus élevées (0,5 à 1 mg/kg).
Les patients dont les symptômes réapparaissent pendant ou après la diminution progressive du traitement peuvent nécessiter un traitement d’entretien continu. Les corticostéroïdes systémiques tels que la prednisone sont souvent utilisés à faibles doses (5 à 10 mg/jour, ou la dose minimale requise pour maintenir la réponse).
Cependant, en raison des effets secondaires indésirables à long terme de la corticothérapie systémique, d’autres agents alternatifs, moins susceptibles d’atteindre la circulation systémique, peuvent être envisagés. Une bonne réponse a été obtenue avec l’utilisation du budésonide (3 à 9 mg/jour) ; Il a été démontré que la fluticasone orale diminue l’éosinophilie gastrique concomitante chez les enfants atteints d’œsophagite à éosinophiles.
| Agents d’épargne de stéroïdes |
Chez les personnes nécessitant un traitement d’entretien par corticostéroïdes ou qui ne répondent pas de manière adéquate à leur action, plusieurs agents ont été utilisés, avec des résultats positifs. Plusieurs de ces agents sont ceux utilisés pour le traitement des maladies inflammatoires de l’intestin, comme la mésalazine (ou acide 5-aminosalicylique), l’azathioprine et les agents anti-TNF, comme l’infliximab et l’adalimumab.
D’autres options incluent les stabilisants des mastocytes, tels que le cromoglycate de sodium et le kétotifène, ainsi que le montélukast, un antagoniste des récepteurs des leucotriènes, l’omalizumab, un agent anti-IgE, dont il a été démontré qu’il améliore considérablement les symptômes et réduit le nombre. des éosinophiles gastroduodénaux chez 9 individus atteints de gastro-entérite à éosinophiles.
Il a été constaté que le mépolizumab, un agent bloquant l’interleukine 5, induisait une réponse dans un groupe de 6 patients atteints de gastro-entérite à éosinophiles ou de syndrome hyperéosinophile ; Cependant, une éosinophilie rebond a été observée chez tous les répondeurs, accompagnée d’une rechute clinique.
Il a été démontré qu’un nouvel anticorps dirigé contre CCR3, un récepteur de l’éotaxine exprimé par les éosinophiles, qui facilite leur recrutement vers les sites d’inflammation, diminue l’inflammation et la diarrhée à éosinophiles dans un modèle murin de gastro-entérite à éosinophiles.
| Greffe de microbiote fécal |
Il a été démontré que la transplantation de microbiote fécal est efficace pour le traitement des maladies inflammatoires de l’intestin, notamment l’infection réfractaire à Clostridium difficile et la colite ulcéreuse.
Ce traitement a été utilisé avec succès chez un patient atteint d’entérocolite à éosinophiles touchant l’iléon et le côlon, dont la maladie était réfractaire à la nutrition entérale, à l’azathioprine, aux stéroïdes et à la résection chirurgicale, mais répondait à la transplantation de microbiote fécal provenant d’un seul donneur. , en complément des corticostéroïdes oraux.
| Chirurgie |
Les patients peuvent présenter des complications d’inflammation intestinale, notamment une sténose ou une perforation, et nécessiter un traitement chirurgical ; Ils peuvent être diagnostiqués accidentellement dans un échantillon réséqué chirurgicalement.
Cependant, même en cas d’abdomen aigu, de gastro-entérite à éosinophiles connue (ou fortement suspectée) ou de colite à éosinophiles, les symptômes peuvent répondre à une prise en charge conservatrice avec des immunosuppresseurs.
| Syndrome hyperéosinophile avec atteinte gastro-intestinale |
Le traitement du syndrome hyperéosinophile est différent du traitement de la gastro-entérite à éosinophiles et de la colite. Les corticostéroïdes, les agents inhibiteurs de la tyrosine kinase, tels que l’imatinib, l’hydroxyurée, l’interféron-α et l’anti-interleukine 5,1, sont efficaces pour le traitement du syndrome hyperéosinophile. L’agent antiparasitaire ivermectine est recommandé en cas d’ infection à Strongyloides.
| Évolution clinique de la gastro-entérite à éosinophiles et de la colite à éosinophiles |
L’évolution clinique de ces affections a été décrite sur la base d’un suivi de 43 patients, dont la majorité ont présenté une rémission spontanée ou ont répondu au traitement de première intention. Sur un suivi médian de 13 ans, 42 % de ces patients n’ont pas souffert de rechutes, 37 % ont présenté une évolution des rechutes et des rémissions, et les 21 % restants souffraient d’une maladie chronique sans rémission.
Le suivi pendant plus d’un an des patients de l’étude atteints de colite à éosinophiles a montré que 5 (45 %) ont eu des rechutes après l’arrêt des stéroïdes (13 épisodes) ; 2 d’entre eux ont nécessité un traitement d’entretien à long terme par prednisone ; 1 patient a nécessité une résection iléale en raison d’une perforation.
Bien qu’il n’y ait eu que deux petites études, les données suggèrent que les patients qui répondent au régime initial ou aux corticostéroïdes doivent être surveillés à long terme. Chez les patients qui rechutent pendant la réduction ou l’arrêt de la corticothérapie, la corticothérapie peut être augmentée ou reprise, en vue de passer à un corticostéroïde à plus faible biodisponibilité ou à un agent d’épargne stéroïdienne.
| Conclusions et orientations futures. |
Actuellement, l’éosinophilie dans tout le tractus intestinal peut être reconnue comme un trouble gastro-intestinal à éosinophiles primaire (gastro-entérite à éosinophiles ou colite à éosinophiles) ou secondaire à une cause connue sous le nom d’infection parasitaire.
De nouvelles maladies intestinales à éosinophiles ont également été reconnues, comme l’éosinophilie duodénale dans la dyspepsie fonctionnelle et la spirochétose colique, avec un plus grand nombre d’éosinophiles coliques.
Par conséquent, une approche clinicopathologique réfléchie est nécessaire pour garantir qu’un diagnostic correct et un traitement ciblé soient posés. Davantage d’études cas-témoins et de cohortes sont nécessaires pour mieux caractériser les facteurs étiologiques et l’histoire naturelle de la maladie.
Des études thérapeutiques rigoureuses examinant les agents épargneurs de stéroïdes sont également nécessaires pour fournir un traitement sûr et efficace aux patients nécessitant un traitement d’entretien à long terme.
On espère qu’à mesure que la recherche progresse, la cause (ou les causes) des troubles gastro-intestinaux primaires à éosinophiles pourra être déterminée, permettant ainsi de cibler avec succès des traitements de première intention pour ces troubles, plutôt qu’une approche par essais et erreurs. ce qui constitue une pratique courante.















