Zusammenfassung Es gibt zunehmend Hinweise darauf, dass Dopamin (DA) als negativer Regulator der glukosestimulierten Insulinsekretion (GSIS) fungiert; Der zugrunde liegende molekulare Mechanismus bleibt jedoch unbekannt. Mithilfe der Totalreflexions-Fluoreszenzmikroskopie haben wir die Exozytose von Insulingranula in primären Inselzellen überwacht, um die Wirkung von DA zu untersuchen. Wir fanden heraus, dass D1-Rezeptorantagonisten die DA-vermittelte Hemmung des glukosestimulierten Kalziumflusses (Ca2+) retteten, was auf eine Rolle von D1 bei der DA-vermittelten Hemmung der Insulinsekretion schließen lässt. Die Überexpression von D2, jedoch nicht von D1 allein, übte eine hemmende und toxische Wirkung aus, die den durch Glukose stimulierten Ca2+-Einstrom und die Insulinsekretion in Betazellen unterdrückte. Proximity-Ligation und Western-Blot-Assays zeigten, dass D1 und D2 in Betazellen Heteromere bilden. Die Behandlung mit einem heteromeren D1-D2-Agonisten, SKF83959, hemmte vorübergehend den glukoseinduzierten Ca2+-Einstrom und die Insulingranulat-Exozytose. Durch die Koexpression von D1 und D2 konnten Betazellen der toxischen Wirkung der D2-Überexpression entgehen. DA hemmte vorübergehend den durch Glukose stimulierten Ca2+-Fluss und die Insulin-Exozytose durch Aktivierung des D1-D2-Heteromers. Wir kommen zu dem Schluss , dass D1 Betazellen vor den schädlichen Auswirkungen von DA schützt, indem es die D2-Signalisierung moduliert. Der Befund wird zu unserem Verständnis der DA-Signalübertragung bei der Regulierung der Insulinsekretion beitragen und Methoden zur Vorbeugung und Behandlung von Diabetes verbessern. |
Kommentare
Diabetes ist ein chronischer, lebenslanger Gesundheitszustand, der durch Störungen in der Produktion und Verwendung des Hormons Insulin im Körper verursacht wird . Untersuchungen haben gezeigt, dass das Wohlfühlhormon Dopamin (DA) eine Schlüsselrolle bei der Regulierung der Insulinproduktion durch den Körper spielt .
Insulin wird typischerweise von Zellen in der Bauchspeicheldrüse, sogenannten „Betazellen “, als Reaktion auf Glukose ausgeschüttet, ein Prozess, der treffend als „ glukosestimulierte Insulinsekretion “ (GSIS) bezeichnet wird. Dopamin (DA) reguliert GSIS herunter , was zu vorübergehenden Veränderungen des körpereigenen Insulinspiegels führt. Der Mechanismus hinter dieser Regulierung war jedoch bisher unbekannt.
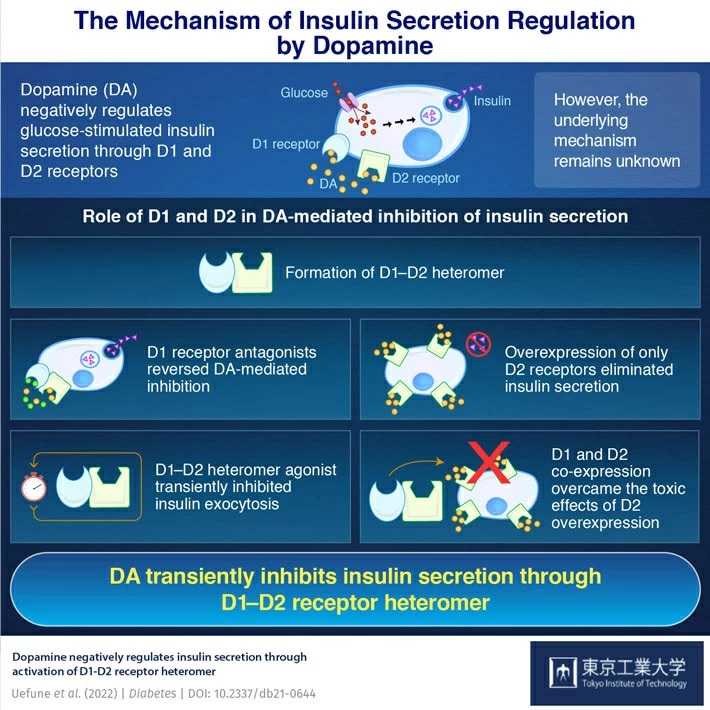
Kürzlich entdeckte ein Team unter der Leitung von Forschern des Tokyo Institute of Technology (Tokyo Tech) den genauen Mechanismus, durch den DA die Insulinsekretion reguliert. Mithilfe einer Technik namens „Total-Internal-Reflection-Fluoreszenzmikroskopie “ konnten sie zeigen, dass DA- „Rezeptoren“ – Proteine in Zellen, an die DA binden kann, D1 und D2 genannt – zusammenarbeiten, um eine vorübergehende Regulierung des Insulins zu erreichen.
„Wir fanden heraus, dass D1-Rezeptor- Antagonisten , Medikamente, die die Aktivierung von D1-Rezeptoren blockieren, die Dopamin-vermittelte Hemmung der Insulinsekretion verringerten. Wir sahen auch, dass die Überexpression nur von D2-Rezeptoren in Betazellen eine hemmende und toxische Wirkung ausübte und die Insulinsekretion in Betazellen aufhob. Dies gab uns einen Hinweis auf den Herunterregulierungsmechanismus“, erklärt Professor Shoen Kume von Tokyo Tech, der die Studie leitete.
Anschließend führte das Forschungsteam weitere Experimente namens „Proximity Ligation“ und „Western Blot Assays“ durch , um die Rezeptoren weiter zu untersuchen. Sie entdeckten, dass sich D1 und D2 zu einem Komplex namens „Heteromer“ zusammenfügten . Bei Aktivierung durch DA hemmt dieses Heteromer vorübergehend die Insulinsekretion . Sie sahen auch, dass die Zellen bei gleichzeitiger Expression von D1 und D2 in Betazellen den toxischen Auswirkungen einer D2-Überexpression entgehen konnten.
Dr. Kume sagt: „Aus diesen Erkenntnissen lässt sich schließen, dass D1 die D2-Signalübertragung moduliert, um Betazellen vor den schädlichen Auswirkungen von DA zu schützen .“ „Diese Studie verbessert unser Verständnis der DA-Signalübertragung bei Diabetes erheblich.“
Das Verständnis des Mechanismus der DA-Signalübertragung bei der Regulierung der Insulinsekretion wird sicherlich neue therapeutische Ziele für die Prävention, Behandlung und Kontrolle von Diabetes liefern.