Résumé Il existe de plus en plus de preuves selon lesquelles la dopamine (DA) fonctionne comme un régulateur négatif de la sécrétion d’insuline stimulée par le glucose (GSIS) ; cependant, le mécanisme moléculaire sous-jacent reste inconnu. En utilisant la microscopie à fluorescence par réflexion interne totale, nous avons surveillé l’exocytose des granules d’insuline dans les cellules des îlots primaires pour disséquer l’effet de la DA. Nous avons constaté que les antagonistes des récepteurs D1 ont sauvé l’inhibition médiée par la DA du flux de calcium (Ca2+) stimulé par le glucose, suggérant un rôle de D1 dans l’inhibition de la sécrétion d’insuline médiée par la DA. La surexpression de D2, mais pas de D1 seul, a exercé un effet inhibiteur et toxique qui a supprimé l’afflux de Ca2+ stimulé par le glucose et la sécrétion d’insuline dans les cellules bêta. Les tests de ligature de proximité et de transfert Western ont révélé que D1 et D2 forment des hétéromères dans les cellules bêta. Le traitement avec un agoniste hétéromère D1-D2, SKF83959, a inhibé de manière transitoire l’afflux de Ca2+ induit par le glucose et l’exocytose des granules d’insuline. La coexpression de D1 et D2 a permis aux cellules bêta d’échapper à l’effet toxique de la surexpression de D2. DA a inhibé de manière transitoire le flux de Ca2+ stimulé par le glucose et l’exocytose de l’insuline en activant l’hétéromère D1-D2. Nous concluons que D1 protège les cellules bêta des effets délétères du DA en modulant la signalisation D2. Cette découverte contribuera à notre compréhension de la signalisation DA dans la régulation de la sécrétion d’insuline et améliorera les méthodes de prévention et de traitement du diabète. |
commentaires
Le diabète est un problème de santé chronique qui dure toute la vie et qui est causé par des anomalies dans la production et l’utilisation de l’hormone insuline dans l’organisme . Des recherches ont montré que la dopamine (DA) , une hormone du bien-être, joue un rôle clé dans la manière dont l’organisme régule la production d’insuline .
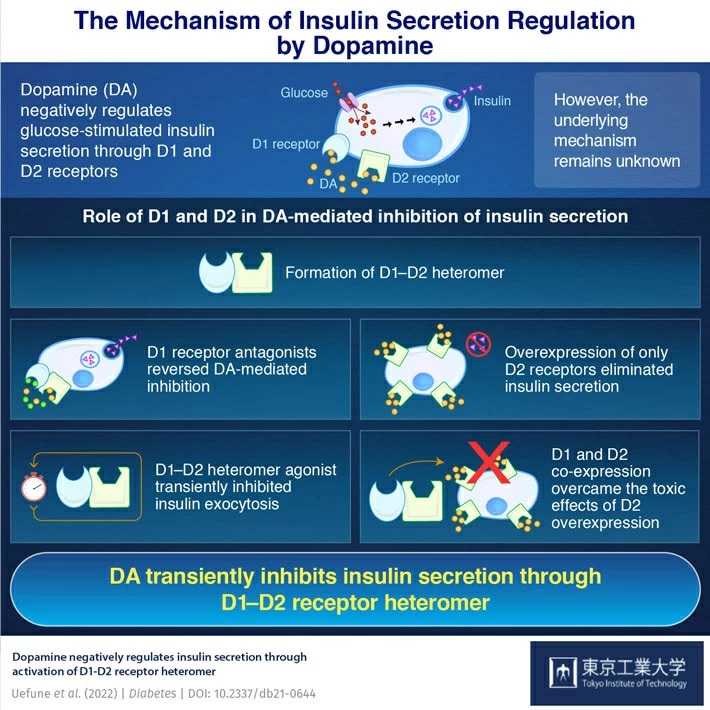
L’insuline est généralement sécrétée par des cellules du pancréas appelées « cellules bêta », en réponse au glucose, un processus appelé à juste titre « sécrétion d’insuline stimulée par le glucose » (GSIS). La dopamine (DA) régule à la baisse le GSIS, entraînant des changements transitoires dans les niveaux d’insuline du corps. Mais le mécanisme à l’origine de cette régulation était inconnu jusqu’à présent.
Récemment, une équipe dirigée par des chercheurs de l’Institut de technologie de Tokyo (Tokyo Tech) a découvert le mécanisme précis par lequel la DA régule les sécrétions d’insuline. En utilisant une technique appelée « microscopie à fluorescence par réflexion interne totale », ils ont pu révéler que les « récepteurs » DA – des protéines dans les cellules auxquelles la DA peut se lier, appelées D1 et D2 – agissent ensemble pour obtenir une régulation transitoire de l’insuline.
« Nous avons constaté que les antagonistes des récepteurs D1 , médicaments qui bloquent l’activation des récepteurs D1, diminuaient l’inhibition de la sécrétion d’insuline médiée par la dopamine. Nous avons également constaté que la surexpression des seuls récepteurs D2 dans les cellules bêta exerçait un effet inhibiteur et toxique et abolissait la sécrétion d’insuline dans les cellules bêta. Cela nous a donné une idée du mécanisme de régulation négative », explique le professeur Shoen Kume de Tokyo Tech, qui a dirigé l’étude.
L’équipe de recherche a ensuite réalisé d’autres expériences appelées « ligature de proximité » et « tests Western blot » pour étudier plus en détail les récepteurs. Ils ont découvert que D1 et D2 se sont réunis pour former un complexe appelé « hétéromère » . Lorsqu’il est activé par DA, cet hétéromère inhibe transitoirement la sécrétion d’insuline . Ils ont également constaté que lorsque D1 et D2 étaient exprimés simultanément dans les cellules bêta, celles-ci pouvaient échapper aux effets toxiques de la surexpression de D2.
Le Dr Kume déclare : « À partir de ces résultats, on peut conclure que D1 module la signalisation D2 pour protéger les cellules bêta des effets nocifs de la DA. "Cette étude améliore considérablement notre compréhension de la signalisation DA dans le diabète."
Comprendre le mécanisme de signalisation DA dans la régulation de la sécrétion d’insuline fournira sûrement de nouvelles cibles thérapeutiques pour la prévention, le traitement et le contrôle du diabète.