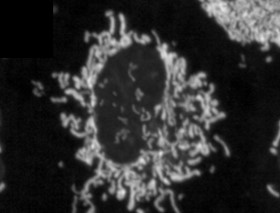
Fettleibigkeit führt aufgrund der RalA-Aktivierung zu einer Fragmentierung und Funktionsstörung der Mitochondrien in weißen Adipozyten Zusammenfassung Mitochondriale Dysfunktion ist ein charakteristisches Merkmal von Fettleibigkeit bei Menschen und Nagetieren, Insulinresistenz und Fettlebererkrankungen. Hier zeigen wir, dass die Fütterung einer fettreichen Diät (HFD) eine mitochondriale Fragmentierung in inguinalen weißen Adipozyten männlicher Mäuse verursacht, was zu einer verringerten Oxidationskapazität durch einen Prozess führt, der von der kleinen GTPase RalA abhängt. RalA-Expression und -Aktivität nehmen in weißen Adipozyten nach einer fettreichen Diät (HFD) zu. Die gezielte Deletion von RalA in weißen Adipozyten verhindert die Fragmentierung der Mitochondrien und verringert die durch HFD verursachte Gewichtszunahme durch Erhöhung der Fettsäureoxidation. Mechanistisch erhöht RalA die Spaltung in Adipozyten, indem es die inhibitorische Ser637-Phosphorylierung des Spaltproteins Drp1 umkehrt, was zu einer erhöhten mitochondrialen Fragmentierung führt. Die Expression des menschlichen Homologen von Drp1, DNM1L, im Fettgewebe korreliert positiv mit Fettleibigkeit und Insulinresistenz. Daher spielt die chronische Aktivierung von RalA eine Schlüsselrolle bei der Unterdrückung des Energieverbrauchs in fettleibigem Fettgewebe, indem sie das Gleichgewicht der mitochondrialen Dynamik in Richtung einer übermäßigen Spaltung verschiebt, was zu Gewichtszunahme und Stoffwechselstörungen beiträgt. |
Kommentare
Forscher fanden heraus, dass bei der Fütterung von Mäusen mit einer fettreichen Diät die Mitochondrien in ihren Fettzellen zusammenbrachen und sie weniger in der Lage waren, Fett zu verbrennen, was zu einer Gewichtszunahme führte. Sie fanden auch heraus, dass sie den Effekt umkehren könnten, indem sie auf ein einzelnes Gen abzielen, was auf eine neue Behandlungsstrategie für Fettleibigkeit hindeutet.
Die Zahl der Menschen mit Fettleibigkeit hat sich seit 1975 fast verdreifacht, was zu einer weltweiten Epidemie führte. Während Lebensstilfaktoren wie Ernährung und Bewegung eine Rolle bei der Entstehung und dem Fortschreiten von Fettleibigkeit spielen, haben Wissenschaftler erkannt, dass Fettleibigkeit auch mit intrinsischen Stoffwechselstörungen verbunden ist. Jetzt haben Forscher der University of California, San Diego School of Medicine, ein neues Licht auf die Auswirkungen von Fettleibigkeit auf unsere Mitochondrien geworfen, die wichtigsten Strukturen in unseren Energie produzierenden Zellen.
In einer in „Nature Metabolism“ veröffentlichten Studie fanden Forscher heraus, dass sich die Mitochondrien in ihren Fettzellen aufteilten, wenn Mäusen eine fettreiche Ernährung verabreicht wurde, und zwar in kleinere Mitochondrien mit verminderter Fähigkeit zur Fettverbrennung. Darüber hinaus entdeckten sie, dass dieser Prozess von einem einzigen Gen gesteuert wird. Indem sie dieses Gen aus den Mäusen entfernten, konnten sie sie vor einer übermäßigen Gewichtszunahme schützen, selbst wenn sie sich genauso fettreich ernährten wie andere Mäuse.
„Kalorienüberlastung durch übermäßiges Essen kann zu Gewichtszunahme führen und löst außerdem eine Stoffwechselkaskade aus, die die Energieverbrennung reduziert und Fettleibigkeit noch verschlimmert“, sagte Alan Saltiel, PhD, Professor an der medizinischen Fakultät der School of Medicine. von der UC San Diego. „Das von uns identifizierte Gen ist ein entscheidender Teil des Übergangs von gesundem Gewicht zu Fettleibigkeit.“
Fettleibigkeit, von der mehr als 40 % der Erwachsenen in den Vereinigten Staaten betroffen sind, entsteht, wenn der Körper zu viel Fett ansammelt, das hauptsächlich im Fettgewebe gespeichert wird. Fettgewebe bietet typischerweise wichtige mechanische Vorteile, indem es lebenswichtige Organe polstert und isoliert. Es hat auch wichtige Stoffwechselfunktionen, wie die Freisetzung von Hormonen und anderen Zellsignalmolekülen, die andere Gewebe anweisen, Energie zu verbrennen oder zu speichern.
Bei kalorischen Ungleichgewichten wie Fettleibigkeit beginnt die Fähigkeit der Fettzellen, Energie zu verbrennen, zu versagen, was einer der Gründe dafür ist, dass es Menschen mit Fettleibigkeit schwer fallen kann, Gewicht zu verlieren. Wie diese Stoffwechselstörungen entstehen, ist eines der größten Rätsel im Zusammenhang mit Fettleibigkeit.
Um diese Frage zu beantworten, fütterten Forscher Mäuse mit einer fettreichen Diät und maßen die Auswirkungen dieser Diät auf die Mitochondrien ihrer Fettzellen, Strukturen innerhalb der Zellen, die bei der Fettverbrennung helfen. Sie entdeckten ein ungewöhnliches Phänomen. Nach dem Verzehr einer fettreichen Diät kam es in Teilen des Fettgewebes der Mäuse zu einer Fragmentierung der Mitochondrien , die sich in viele kleinere, wirkungslose Mitochondrien aufspalteten, die weniger Fett verbrannten.
Sie entdeckten nicht nur diesen metabolischen Effekt, sondern auch, dass er durch die Aktivität eines einzelnen Moleküls namens RaIA angetrieben wird, das viele Funktionen hat, darunter die Unterstützung beim Abbau von Mitochondrien, wenn diese nicht richtig funktionieren. Neue Forschungsergebnisse deuten darauf hin, dass eine Überaktivität dieses Moleküls die normale Funktion der Mitochondrien beeinträchtigt und Stoffwechselprobleme im Zusammenhang mit Fettleibigkeit auslöst.
„Im Wesentlichen scheint die chronische Aktivierung von RaIA eine entscheidende Rolle bei der Unterdrückung des Energieaufwands in fettleibigem Fettgewebe zu spielen“, sagte Saltiel. „Durch das Verständnis dieses Mechanismus sind wir der Entwicklung gezielter Therapien einen Schritt näher gekommen, die Gewichtszunahme und damit verbundene Stoffwechselstörungen durch eine Steigerung der Fettverbrennung bekämpfen könnten.“
Durch die Löschung des mit RaIA assoziierten Gens konnten die Forscher die Mäuse vor einer ernährungsbedingten Gewichtszunahme schützen . Als die Forscher tiefer in die Biochemie eintauchten, fanden sie heraus, dass einige der von RaIA bei Mäusen betroffenen Proteine mit menschlichen Proteinen vergleichbar sind, die mit Fettleibigkeit und Insulinresistenz in Verbindung gebracht werden, was darauf hindeutet, dass ähnliche Mechanismen Fettleibigkeit auslösen könnten. menschlich.
„Der direkte Vergleich zwischen der von uns entdeckten grundlegenden Biologie und den tatsächlichen klinischen Ergebnissen unterstreicht die Relevanz der Ergebnisse für den Menschen und legt nahe, dass wir zur Behandlung oder Vorbeugung von Fettleibigkeit beitragen können, indem wir mit neuen Therapien auf den RaIA-Signalweg abzielen“, sagte Saltiel. „Wir fangen gerade erst an, den komplexen Stoffwechsel dieser Krankheit zu verstehen, aber die zukünftigen Möglichkeiten sind aufregend.“
Mitautoren der Studie: Wenmin Xia, Preethi Veeragandham, Yu Cao Yayun Xu, Torrey Rhyne, Jiaxin Qian, Ying Jones, Chao-Wei Hung, Zichen Wang, Hiroyuki Hakozaki und Johannes Schöneberg vom Texas Health Science Center, Hui Gao und Michael. Ryden am Karolinska Institute, Christopher Liddle, Ruth Yu, Michael Downes, Ronald Evans und Jianfeng Huang am Salk Institute for Biological Studies; von der Cornell University.
Diese Studie wurde teilweise von den National Institutes of Health finanziert (Zuschüsse P30DK063491, R01DK122804, R01DK124496, R01DK125820 und R01DK128796).