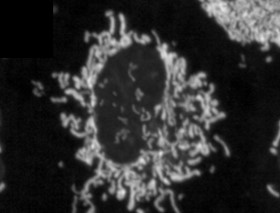
L’obésité provoque une fragmentation mitochondriale et un dysfonctionnement des adipocytes blancs en raison de l’activation de RalA Résumé Le dysfonctionnement mitochondrial est une caractéristique de l’obésité chez les humains et les rongeurs, de la résistance à l’insuline et de la stéatose hépatique. Nous montrons ici que l’alimentation avec un régime riche en graisses (HFD) provoque une fragmentation des mitochondries dans les adipocytes blancs inguinaux de souris mâles, conduisant à une capacité oxydative réduite grâce à un processus dépendant de la petite GTPase RalA. L’expression et l’activité de RalA augmentent dans les adipocytes blancs après un régime riche en graisses (HFD). La suppression ciblée de RalA dans les adipocytes blancs empêche la fragmentation mitochondriale et diminue la prise de poids induite par HFD en augmentant l’oxydation des acides gras. Mécaniquement, RalA augmente la fission dans les adipocytes en inversant la phosphorylation inhibitrice Ser637 de la protéine de fission Drp1, conduisant à une fragmentation mitochondriale accrue. L’expression dans le tissu adipeux de l’homologue humain de Drp1, DNM1L, est positivement corrélée à l’obésité et à la résistance à l’insuline. Par conséquent, l’activation chronique de RalA joue un rôle clé dans la répression de la dépense énergétique dans le tissu adipeux obèse en déplaçant l’équilibre de la dynamique mitochondriale vers une fission excessive, contribuant ainsi à la prise de poids et au dysfonctionnement métabolique. |
commentaires
Les chercheurs ont découvert que lorsque les souris recevaient un régime riche en graisses, les mitochondries de leurs cellules graisseuses se dégradaient et elles étaient moins capables de brûler les graisses, ce qui entraînait une prise de poids. Ils ont également découvert qu’ils pouvaient inverser l’effet en ciblant un seul gène, ce qui suggère une nouvelle stratégie de traitement de l’obésité.
Le nombre de personnes obèses a presque triplé depuis 1975, provoquant une épidémie mondiale. Bien que des facteurs liés au mode de vie, tels que l’alimentation et l’exercice physique, jouent un rôle dans le développement et la progression de l’obésité, les scientifiques ont compris que l’obésité est également associée à des anomalies métaboliques intrinsèques. Aujourd’hui, des chercheurs de la faculté de médecine de l’Université de Californie à San Diego ont jeté un nouvel éclairage sur la façon dont l’obésité affecte nos mitochondries, les structures les plus importantes de nos cellules productrices d’énergie.
Dans une étude publiée dans Nature Metabolism , les chercheurs ont découvert que lorsque les souris étaient nourries avec un régime riche en graisses, les mitochondries de leurs cellules adipeuses se divisaient en mitochondries plus petites ayant une capacité réduite à brûler les graisses. De plus, ils ont découvert que ce processus est contrôlé par un seul gène. En supprimant ce gène des souris, ils ont pu les protéger d’une prise de poids excessive, même lorsqu’elles suivaient le même régime riche en graisses que les autres souris.
"La surcharge calorique due à une alimentation excessive peut entraîner une prise de poids et déclencher une cascade métabolique qui réduit la combustion d’énergie, aggravant encore l’obésité", a déclaré Alan Saltiel, PhD, professeur au département de médecine de la faculté de médecine. de l’Université de Californie à San Diego. "Le gène que nous avons identifié joue un rôle essentiel dans la transition du poids santé à l’obésité."
L’obésité, qui touche plus de 40 % des adultes aux États-Unis, survient lorsque le corps accumule trop de graisse, stockée principalement dans le tissu adipeux. Le tissu adipeux offre généralement des avantages mécaniques importants en amortissant les organes vitaux et en les isolant. Il a également des fonctions métaboliques importantes, telles que la libération d’hormones et d’autres molécules de signalisation cellulaire qui ordonnent à d’autres tissus de brûler ou de stocker de l’énergie.
Dans le cas de déséquilibres caloriques tels que l’obésité, la capacité des cellules adipeuses à brûler de l’énergie commence à diminuer, ce qui est l’une des raisons pour lesquelles les personnes obèses peuvent avoir des difficultés à perdre du poids. La façon dont ces anomalies métaboliques commencent est l’un des plus grands mystères entourant l’obésité.
Pour répondre à cette question, les chercheurs ont nourri des souris avec un régime riche en graisses et ont mesuré l’impact de ce régime sur les mitochondries de leurs cellules adipeuses, des structures au sein des cellules qui aident à brûler les graisses. Ils ont découvert un phénomène inhabituel. Après avoir consommé un régime riche en graisses, les mitochondries de certaines parties du tissu adipeux des souris ont subi une fragmentation , se divisant en de nombreuses mitochondries plus petites et inefficaces qui brûlaient moins de graisse.
En plus de découvrir cet effet métabolique, ils ont également découvert qu’il est dû à l’activité d’une seule molécule, appelée RaIA, qui remplit de nombreuses fonctions, notamment celle d’aider à décomposer les mitochondries lorsqu’elles ne fonctionnent pas correctement. De nouvelles recherches suggèrent que lorsque cette molécule est hyperactive, elle interfère avec le fonctionnement normal des mitochondries, déclenchant ainsi des problèmes métaboliques associés à l’obésité.
"Essentiellement, l’activation chronique de RaIA semble jouer un rôle essentiel dans la suppression de la dépense énergétique dans le tissu adipeux obèse", a déclaré Saltiel. "En comprenant ce mécanisme, nous sommes sur le point de développer des thérapies ciblées qui pourraient lutter contre la prise de poids et les dysfonctionnements métaboliques associés en augmentant la combustion des graisses."
En supprimant le gène associé à RaIA, les chercheurs ont pu protéger les souris contre la prise de poids induite par l’alimentation. En approfondissant la biochimie en jeu, les chercheurs ont découvert que certaines des protéines affectées par RaIA chez la souris sont analogues aux protéines humaines associées à l’obésité et à la résistance à l’insuline, ce qui suggère que des mécanismes similaires pourraient être à l’origine de l’obésité. humain.
"La comparaison directe entre la biologie fondamentale que nous avons découverte et les résultats cliniques réels souligne la pertinence des résultats pour l’homme et suggère que nous pouvons aider à traiter ou à prévenir l’obésité en ciblant la voie RaIA avec de nouvelles thérapies", a déclaré Saltiel. "Nous commençons seulement à comprendre le métabolisme complexe de cette maladie, mais les possibilités futures sont passionnantes."
Co-auteurs de l’étude : Wenmin Xia, Preethi Veeragandham, Yu Cao Yayun Xu, Torrey Rhyne, Jiaxin Qian, Ying Jones, Chao-Wei Hung, Zichen Wang, Hiroyuki Hakozaki et Johannes Schoneberg du Texas Health Science Center, Hui Gao et Michael. Ryden à l’Institut Karolinska, Christopher Liddle, Ruth Yu, Michael Downes, Ronald Evans et Jianfeng Huang au Salk Institute for Biological Studies ; de l’Université Cornell.
Cette étude a été financée en partie par les National Institutes of Health (subventions P30DK063491, R01DK122804, R01DK124496, R01DK125820 et R01DK128796).