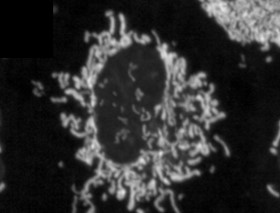
L’obesità provoca frammentazione mitocondriale e disfunzione negli adipociti bianchi a causa dell’attivazione di RalA Riepilogo La disfunzione mitocondriale è una caratteristica dell’obesità negli esseri umani e nei roditori, della resistenza all’insulina e della malattia del fegato grasso. Qui mostriamo che l’alimentazione con una dieta ricca di grassi (HFD) provoca la frammentazione mitocondriale negli adipociti bianchi inguinali di topi maschi, portando a una ridotta capacità ossidativa attraverso un processo dipendente dalla piccola GTPasi RalA. Aumento dell’espressione e dell’attività di RalA negli adipociti bianchi dopo una dieta ricca di grassi (HFD). L’eliminazione mirata di RalA negli adipociti bianchi previene la frammentazione mitocondriale e diminuisce l’aumento di peso indotto dall’HFD aumentando l’ossidazione degli acidi grassi. Meccanicamente, RalA aumenta la fissione negli adipociti invertendo la fosforilazione inibitoria Ser637 della proteina di fissione Drp1, portando ad un aumento della frammentazione mitocondriale. L’espressione nel tessuto adiposo dell’omologo umano di Drp1, DNM1L, è positivamente correlata con l’obesità e la resistenza all’insulina. Pertanto, l’attivazione cronica di RalA gioca un ruolo chiave nel reprimere il dispendio energetico nel tessuto adiposo obeso spostando l’equilibrio della dinamica mitocondriale verso un’eccessiva fissione, contribuendo all’aumento di peso e alla disfunzione metabolica. |
Commenti
I ricercatori hanno scoperto che quando i topi venivano nutriti con una dieta ricca di grassi, i mitocondri all’interno delle loro cellule adipose si rompevano ed erano meno in grado di bruciare i grassi, con conseguente aumento di peso. Hanno anche scoperto che potrebbero invertire l’effetto prendendo di mira un singolo gene, suggerendo una nuova strategia di trattamento per l’obesità.
Il numero di persone affette da obesità è quasi triplicato dal 1975, provocando un’epidemia globale. Sebbene fattori legati allo stile di vita come la dieta e l’esercizio fisico svolgano un ruolo nello sviluppo e nella progressione dell’obesità, gli scienziati sono giunti a comprendere che l’obesità è anche associata ad anomalie metaboliche intrinseche. Ora, i ricercatori della University of California, San Diego School of Medicine, hanno gettato nuova luce su come l’obesità colpisce i nostri mitocondri, le strutture più importanti nelle nostre cellule produttrici di energia.
In uno studio pubblicato su Nature Metabolism , i ricercatori hanno scoperto che quando i topi venivano nutriti con una dieta ricca di grassi, i mitocondri all’interno delle loro cellule adipose si dividevano in mitocondri più piccoli con ridotta capacità di bruciare i grassi. Inoltre, hanno scoperto che questo processo è controllato da un singolo gene. Rimuovendo questo gene dai topi, sono stati in grado di proteggerli dall’eccessivo aumento di peso, anche quando seguivano la stessa dieta ricca di grassi degli altri topi.
"Il sovraccarico calorico derivante dall’eccesso di cibo può portare ad un aumento di peso e innesca anche una cascata metabolica che riduce il consumo di energia, peggiorando ulteriormente l’obesità", ha affermato Alan Saltiel, PhD, professore presso il Dipartimento di Medicina della Facoltà di Medicina. dell’UC San Diego. "Il gene che abbiamo identificato è una parte fondamentale della transizione dal peso sano all’obesità".
L’obesità, che colpisce oltre il 40% degli adulti negli Stati Uniti, si verifica quando il corpo accumula troppo grasso, che viene immagazzinato principalmente nel tessuto adiposo. Il tessuto adiposo fornisce in genere importanti benefici meccanici ammortizzando gli organi vitali e fornendo isolamento. Ha anche importanti funzioni metaboliche, come il rilascio di ormoni e altre molecole di segnalazione cellulare che istruiscono altri tessuti a bruciare o immagazzinare energia.
In caso di squilibri calorici come l’obesità, la capacità delle cellule adipose di bruciare energia inizia a diminuire, il che è uno dei motivi per cui le persone obese possono avere difficoltà a perdere peso. Il modo in cui iniziano queste anomalie metaboliche è uno dei più grandi misteri che circondano l’obesità.
Per rispondere a questa domanda, i ricercatori hanno nutrito i topi con una dieta ricca di grassi e hanno misurato l’impatto di questa dieta sui mitocondri delle cellule adipose, strutture all’interno delle cellule che aiutano a bruciare i grassi. Hanno scoperto un fenomeno insolito. Dopo aver consumato una dieta ricca di grassi, i mitocondri in alcune parti del tessuto adiposo dei topi sono andati incontro a frammentazione , dividendosi in molti mitocondri più piccoli e inefficaci che bruciavano meno grassi.
Oltre a scoprire questo effetto metabolico, hanno anche scoperto che è guidato dall’attività di una singola molecola, chiamata RaIA, che ha molte funzioni, tra cui aiutare a scomporre i mitocondri quando non funzionano correttamente. Una nuova ricerca suggerisce che quando questa molecola è iperattiva, interferisce con il normale funzionamento dei mitocondri, innescando problemi metabolici associati all’obesità.
"In sostanza, l’attivazione cronica del RaIA sembra svolgere un ruolo fondamentale nel sopprimere il dispendio energetico nel tessuto adiposo obeso", ha affermato Saltiel. "Comprendendo questo meccanismo, siamo un passo avanti verso lo sviluppo di terapie mirate che potrebbero affrontare l’aumento di peso e le disfunzioni metaboliche associate aumentando la combustione dei grassi".
Eliminando il gene associato al RaIA, i ricercatori sono riusciti a proteggere i topi dall’aumento di peso indotto dalla dieta. Scavando più a fondo nella biochimica in gioco, i ricercatori hanno scoperto che alcune delle proteine colpite dal RaIA nei topi sono analoghe alle proteine umane associate all’obesità e alla resistenza all’insulina, suggerendo che meccanismi simili potrebbero causare l’obesità. umano.
"Il confronto diretto tra la biologia fondamentale che abbiamo scoperto e i risultati clinici effettivi sottolinea la rilevanza dei risultati per gli esseri umani e suggerisce che possiamo contribuire a trattare o prevenire l’obesità prendendo di mira il percorso RaIA con nuove terapie", ha affermato Saltiel. "Stiamo appena iniziando a comprendere il complesso metabolismo di questa malattia, ma le possibilità future sono entusiasmanti".
Coautori dello studio: Wenmin Xia, Preethi Veeragandham, Yu Cao Yayun Xu, Torrey Rhyne, Jiaxin Qian, Ying Jones, Chao-Wei Hung, Zichen Wang, Hiroyuki Hakozaki e Johannes Schoneberg del Texas Health Science Center, Hui Gao e Michael. Ryden al Karolinska Institute, Christopher Liddle, Ruth Yu, Michael Downes, Ronald Evans e Jianfeng Huang al Salk Institute for Biological Studies; dalla Cornell University.
Questo studio è stato finanziato, in parte, dal National Institutes of Health (sovvenzioni P30DK063491, R01DK122804, R01DK124496, R01DK125820 e R01DK128796).