Points forts
|
Résumé
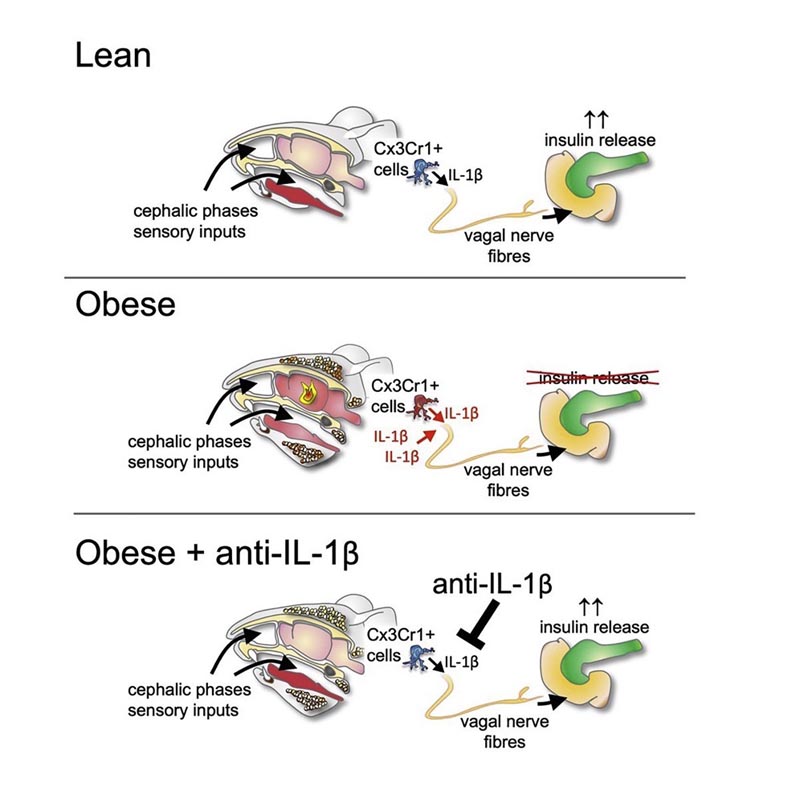
La phase céphalique initiale de la sécrétion d’insuline est médiée par le nerf vague et n’est pas due à la stimulation glycémique des cellules β pancréatiques. Il a récemment été démontré que l’IL-1β stimule la sécrétion postprandiale d’insuline. Nous décrivons ici que cet effet de type incrétine de l’IL-1β implique une transmission neuronale . De plus, nous avons constaté que la libération d’insuline au cours de la phase céphalique était médiée par l’IL-1β de la microglie. De plus, l’IL-1β a activé le nerf vague pour induire la sécrétion d’insuline et réguler l’activité de l’hypothalamus en réponse à la stimulation de la tête. Notamment, la libération d’insuline au cours de la phase céphalique était altérée en cas d’obésité , tant chez la souris que chez l’homme, et chez la souris, cela était dû à une signalisation dérégulée de l’IL-1β. Nos résultats attribuent un rôle régulateur à l’IL-1β dans l’intégration des informations sensorielles dérivées des nutriments, la sécrétion ultérieure d’insuline médiée par les neurones et la dérégulation des réponses de la phase céphalique autonome dans l’obésité.
La sécrétion d’insuline est régulée par plusieurs facteurs. Bien que les effets directs de l’action du glucose sur les cellules β pancréatiques constituent le stimulus le plus important de la sécrétion d’insuline, d’autres mécanismes, tels que la stimulation neuronale et les hormones incrétines , peuvent expliquer jusqu’à 70 à 80 % de la réponse totale. d’insuline à un repas.
La libération d’insuline en phase céphalique est la conséquence de stimuli sensoriels d’origine alimentaire (vue, odorat, goût, stimulation proprioceptive et tactile) agissant sur les récepteurs de la tête et de l’oropharynx avant les effets stimulants directs du glucose. dans les cellules β.
Ces stimuli impliquent alors l’activation du système nerveux parasympathique et la sécrétion d’insuline en aval. Les réponses en phase céphalique sont essentielles dans la régulation postprandiale de l’homéostasie du glucose car un repas qui contourne la cavité buccale et donc les réponses en phase céphalique provoquent une intolérance au glucose . Hormis la signalisation des récepteurs muscariniques dans les cellules β et les monoamines hypothalamiques, aucun médiateur moléculaire de la libération d’insuline en phase céphalique n’a été décrit à ce jour.
L’interleukine 1 bêta (IL-1β) régule la réponse de l’organisme aux lésions tissulaires et aux agents pathogènes. Plus récemment, l’IL-1β s’est révélée être un acteur essentiel à la fois dans la physiologie et dans la pathologie du métabolisme du glucose. En effet, l’activation chronique de l’IL-1β chez les patients atteints du syndrome métabolique favorise la toxicité des cellules β et finalement leur échec, caractéristiques du diabète de type 2 . Contrairement à ces effets délétères à long terme, une prise alimentaire aiguë incite les cellules myéloïdes à produire de l’IL-1β, qui contribue ensuite à la stimulation physiologique postprandiale de la sécrétion d’insuline. Cependant, les mécanismes sous-jacents à cet effet de type incrétine de l’IL-1β sur la libération d’insuline restent inconnus.
Nous émettons l’hypothèse que l’IL-1β exerce son effet sécrétagogue sur la sécrétion d’insuline par stimulation du système nerveux parasympathique . À l’aide de modèles génétiques et pharmacologiques, nous avons constaté que l’IL-1β médie son effet stimulateur sur la sécrétion d’insuline par la signalisation muscarinique centrale. Pour corroborer l’implication neuronale de la libération d’insuline médiée par l’IL-1β, nous avons étudié la réponse insulinique en phase céphalique comme un excellent exemple de sécrétion d’insuline à médiation centrale. Nous avons identifié l’IL1β comme un médiateur crucial de ce réflexe de phase céphalique. Provenant de cellules myéloïdes CX3CR1+ à longue durée de vie, telles que les microglies, il régule l’activité neuronale de l’hypothalamus en réponse à la stimulation de la tête. En particulier, nous avons constaté que la libération d’insuline en phase céphalique est altérée en cas d’obésité , tant chez la souris que chez l’homme, de manière dépendante de l’IL-1β chez la souris. Par conséquent, l’IL-1β joue un rôle régulateur dans la stimulation neuronale de la sécrétion d’insuline et dans la dérégulation des réponses de la phase céphalique autonome en cas d’obésité.
commentaires
Avant même que les glucides n’atteignent la circulation sanguine, la simple vue et l’odeur d’un repas déclenche la libération d’insuline . Pour la première fois, des chercheurs de l’Université de Bâle et de l’Hôpital universitaire de Bâle ont montré que cette libération d’insuline dépend d’une réponse inflammatoire à court terme qui se produit dans ces circonstances. Cependant, chez les personnes en surpoids , cette réponse inflammatoire est si excessive qu’elle peut affecter la sécrétion d’insuline.
Même l’anticipation d’un prochain repas déclenche une série de réactions dans le corps, la plus familière étant peut-être la salive dans la bouche. Mais l’hormone insuline , qui régule la glycémie, entre également en jeu avant même que nous prenions cette première bouchée. Les experts appellent cela la phase à médiation neuronale (ou céphalique) de la sécrétion d’insuline.
L’alimentation stimule les défenses immunitaires
Dans le passé, cependant, on ne savait pas clairement comment la perception sensorielle d’un repas générait un signal au pancréas pour augmenter la production d’insuline. Des chercheurs de l’Université de Bâle et de l’hôpital universitaire de Bâle ont désormais identifié une pièce importante du puzzle : un facteur inflammatoire appelé interleukine 1 bêta (IL1B), qui est également impliqué dans la réponse immunitaire aux agents pathogènes ou aux lésions tissulaires. . L’équipe a publié ses conclusions dans la revue Cell Metabolism .
"Le fait que ce facteur inflammatoire soit responsable d’une part considérable de la sécrétion normale d’insuline chez les individus en bonne santé est surprenant, car il est également impliqué dans le développement du diabète de type 2", explique le professeur Marc Donath, responsable de l’étude. , du Département de Biomédecine et Clinique d’Endocrinologie.
Également connu sous le nom de « diabète de l’adulte », cette forme de diabète est causée par une inflammation chronique qui endommage, entre autres, les cellules productrices d’insuline du pancréas. Il s’agit d’une autre situation dans laquelle l’IL1B joue un rôle clé ; dans ce cas, il est produit et sécrété en quantités trop importantes. Dans cette optique, des études cliniques examinent actuellement si les inhibiteurs de ce facteur inflammatoire peuvent être utilisés comme agents thérapeutiques contre le diabète.
Réponse inflammatoire de courte durée
Les circonstances sont différentes lorsqu’il s’agit de sécrétion d’insuline à médiation neuronale : « L’odeur et la vue d’un repas stimulent des cellules immunitaires spécifiques du cerveau appelées microglies », explique l’auteur de l’étude, le Dr Sophia Wiedemann, médecin résident. de médecine interne. "Ces cellules sécrètent brièvement l’IL1B, qui à son tour affecte le système nerveux autonome via le nerf vague ." Ce système transmet ensuite le signal au site de sécrétion d’insuline, c’est-à-dire le pancréas.
Cependant, dans le cas de l’obésité morbide , cette phase de sécrétion d’insuline à médiation neuronale est perturbée . Plus précisément, en raison de la réponse inflammatoire initiale excessive, comme l’explique la doctorante Kelly Trimigliozzi, qui a réalisé la majeure partie de l’étude en collaboration avec Wiedemann.
« Nos résultats indiquent que l’IL1B joue un rôle important dans la liaison des informations sensorielles, telles que la vue et l’odeur d’un repas, à la sécrétion ultérieure d’insuline à médiation neuronale, et dans la régulation de cette connexion », résume Marc. Donat.
Conclusions En résumé, nos résultats attribuent un rôle régulateur à l’IL-1β dans l’intégration des informations sensorielles dérivées des nutriments, la sécrétion ultérieure d’insuline médiée par les neurones et la dérégulation des réponses de la phase céphalique autonome dans l’obésité. Ceci identifie un circuit endocrinien neuroimmunologique dans la régulation de la sécrétion d’insuline. |
















