Höhepunkte
|
Zusammenfassung
Die anfängliche kephale Phase der Insulinsekretion wird durch den Vagusnerv vermittelt und ist nicht auf eine glykämische Stimulation der β-Zellen der Bauchspeicheldrüse zurückzuführen. Kürzlich wurde gezeigt, dass IL-1β die postprandiale Insulinsekretion stimuliert. Hier beschreiben wir, dass dieser Inkretin-ähnliche Effekt von IL-1β eine neuronale Übertragung beinhaltet . Darüber hinaus fanden wir heraus, dass die Insulinfreisetzung in der Kopfphase durch IL-1β aus Mikroglia vermittelt wurde. Darüber hinaus aktivierte IL-1β den Vagusnerv , um die Insulinsekretion zu induzieren, und regulierte die Aktivität des Hypothalamus als Reaktion auf die Kopfstimulation. Bemerkenswerterweise war die Insulinfreisetzung in der Kopfphase bei Fettleibigkeit sowohl bei Mäusen als auch beim Menschen beeinträchtigt, und bei Mäusen war dies auf eine fehlregulierte IL-1β-Signalübertragung zurückzuführen. Unsere Ergebnisse schreiben IL-1β eine regulatorische Rolle bei der Integration nährstoffbezogener sensorischer Informationen, der anschließenden neuronenvermittelten Insulinsekretion und der Fehlregulation der Reaktionen der autonomen Kopfphase bei Fettleibigkeit zu.
Einführung
Die Insulinsekretion wird durch mehrere Faktoren reguliert. Obwohl die direkten Auswirkungen der Glukosewirkung auf die β-Zellen der Bauchspeicheldrüse den wichtigsten Stimulus der Insulinsekretion darstellen, können andere Mechanismen wie neuronale Stimulation und Inkretinhormone bis zu 70–80 % der Gesamtreaktion erklären. Insulin zu einer Mahlzeit.
Die Insulinfreisetzung in der Kopfphase ist die Folge sensorischer Reize aus der Nahrung (Sehen, Riechen, Schmecken, propriozeptive und taktile Stimulation), die vor der direkten stimulierenden Wirkung von Glukose auf Rezeptoren im Kopf und im Oropharynx wirken . in β-Zellen.
Diese Reize beinhalten dann die Aktivierung des Parasympathikus und die nachgeschaltete Insulinsekretion. Reaktionen der kephalen Phase sind für die postprandiale Regulierung der Glukosehomöostase von wesentlicher Bedeutung, da eine Mahlzeit, die die Mundhöhle und damit die Reaktionen der kephalen Phase umgeht, eine Glukoseintoleranz verursacht . Abgesehen von der Muskarinrezeptor-Signalisierung in β-Zellen und hypothalamischen Monoaminen wurde bisher kein molekularer Mediator der Insulinfreisetzung in der Kopfphase beschrieben.
Interleukin 1 Beta (IL-1β) reguliert die Reaktion des Körpers auf Gewebeschäden und Krankheitserreger. Kürzlich wurde gezeigt, dass IL-1β eine wesentliche Rolle sowohl in der Physiologie als auch in der Pathologie des Glukosestoffwechsels spielt. Tatsächlich fördert die chronische Aktivierung von IL-1β bei Patienten mit metabolischem Syndrom die β-Zell-Toxizität und letztendlich das Versagen, Kennzeichen von Typ-2-Diabetes . Im Gegensatz zu diesen langfristigen schädlichen Auswirkungen regt die akute Nahrungsaufnahme myeloische Zellen zur Produktion von IL-1β an, was dann zur physiologischen postprandialen Stimulation der Insulinsekretion beiträgt. Die Mechanismen, die dieser inkretinähnlichen Wirkung von IL-1β auf die Insulinfreisetzung zugrunde liegen, sind jedoch noch unbekannt.
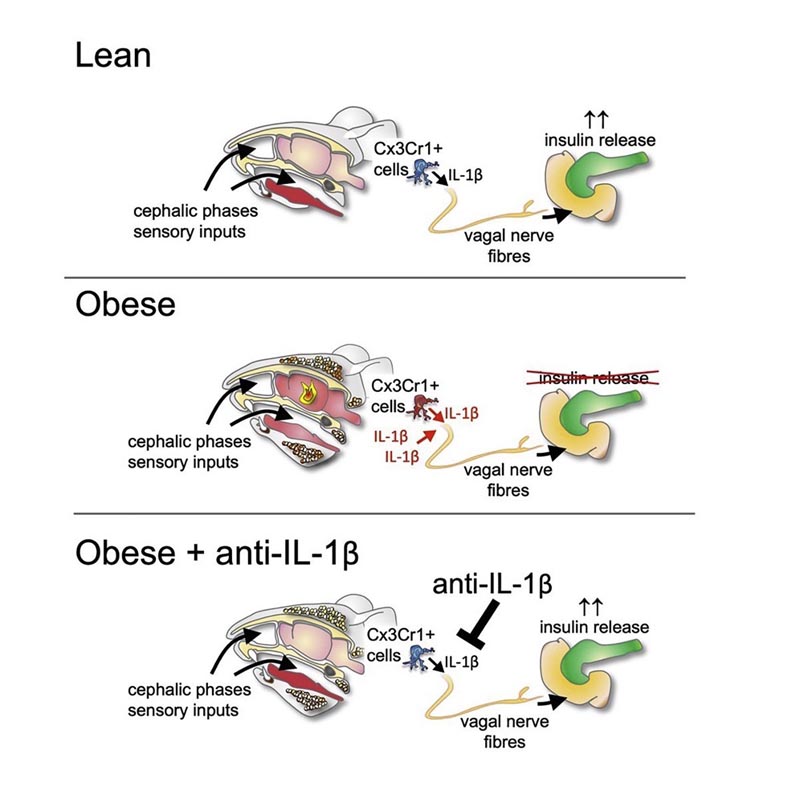
Wir nehmen an, dass IL-1β seine sekretagogene Wirkung auf die Insulinsekretion durch Stimulation des parasympathischen Nervensystems ausübt. Mithilfe genetischer und pharmakologischer Modelle haben wir herausgefunden, dass IL-1β seine stimulierende Wirkung auf die Insulinsekretion durch zentrale Muskarinsignale vermittelt. Um die neuronale Beteiligung der IL-1β-vermittelten Insulinfreisetzung zu bestätigen, untersuchten wir die Insulinreaktion in der Kopfphase als hervorragendes Beispiel für die zentral vermittelte Insulinsekretion. Wir identifizierten IL1β als einen entscheidenden Mediator dieses Kopfphasenreflexes. Es stammt aus langlebigen CX3CR1+-Myeloidzellen wie Mikroglia und regulierte die neuronale Aktivität im Hypothalamus als Reaktion auf Kopfstimulation. Insbesondere fanden wir heraus, dass die Insulinfreisetzung in der Kopfphase bei Fettleibigkeit sowohl bei Mäusen als auch beim Menschen in einer IL-1β-abhängigen Weise bei Mäusen beeinträchtigt ist. Daher spielt IL-1β eine regulatorische Rolle bei der neuronalen Stimulation der Insulinsekretion und bei der Deregulierung der Reaktionen der autonomen Kopfphase bei Fettleibigkeit.
Kommentare
Noch bevor Kohlenhydrate in den Blutkreislauf gelangen, löst der bloße Anblick und Geruch einer Mahlzeit die Ausschüttung von Insulin aus . Forscher der Universität Basel und des Universitätsspitals Basel haben erstmals gezeigt, dass diese Insulinausschüttung von einer kurzfristigen Entzündungsreaktion abhängt , die unter diesen Umständen auftritt. Bei übergewichtigen Personen ist diese Entzündungsreaktion jedoch so stark, dass sie die Insulinsekretion beeinträchtigen kann.
Schon die Vorfreude auf eine bevorstehende Mahlzeit löst eine Reihe von Reaktionen im Körper aus, von denen die Speichelfluss im Mund vielleicht die bekannteste ist. Aber auch das Hormon Insulin , das den Blutzucker reguliert, kommt schon vor dem ersten Bissen ins Spiel. Experten bezeichnen dies als die neural vermittelte (oder kephale) Phase der Insulinsekretion.
Nahrung stimuliert die Immunabwehr
Bisher war jedoch unklar, wie die sensorische Wahrnehmung einer Mahlzeit ein Signal an die Bauchspeicheldrüse auslöst, die Insulinproduktion zu steigern. Nun haben Forschende der Universität Basel und des Universitätsspitals Basel ein wichtiges Puzzleteil identifiziert: einen Entzündungsfaktor namens Interleukin 1 Beta (IL1B), der auch an der Immunantwort auf Krankheitserreger oder Gewebeschäden beteiligt ist. . Das Team hat über seine Ergebnisse in der Fachzeitschrift Cell Metabolism berichtet .
„Dass dieser Entzündungsfaktor für einen erheblichen Anteil der normalen Insulinsekretion bei gesunden Menschen verantwortlich ist, ist überraschend, da er auch an der Entstehung von Typ-2-Diabetes beteiligt ist“, erklärt Studienleiter Professor Marc Donath. , von der Klinik für Biomedizin und Endokrinologie.
Diese Diabetesform, auch „Altersdiabetes “ genannt , wird durch eine chronische Entzündung verursacht, die unter anderem die insulinproduzierenden Zellen der Bauchspeicheldrüse schädigt. Dies ist eine weitere Situation, in der IL1B eine Schlüsselrolle spielt; in diesem Fall wird es in übermäßig großen Mengen produziert und ausgeschieden. Vor diesem Hintergrund wird nun in klinischen Studien untersucht, ob Hemmstoffe gegen diesen Entzündungsfaktor für den Einsatz als Therapeutika bei Diabetes geeignet sind.
Kurzlebige Entzündungsreaktion
Anders verhält es sich bei der neuronal vermittelten Insulinsekretion: „Der Geruch und Anblick einer Mahlzeit stimuliert bestimmte Immunzellen im Gehirn, sogenannte Mikroglia “, sagt Studienautorin Dr. Sophia Wiedemann, eine niedergelassene Ärztin. der Inneren Medizin. „Diese Zellen sezernieren kurzzeitig IL1B, das wiederum über den Vagusnerv das autonome Nervensystem beeinflusst .“ Dieses System leitet das Signal dann an den Ort der Insulinsekretion, also die Bauchspeicheldrüse, weiter.
Bei krankhafter Adipositas ist diese Phase der neuronal vermittelten Insulinsekretion jedoch gestört . Insbesondere aufgrund der übermäßigen anfänglichen Entzündungsreaktion, wie die Doktorandin Kelly Trimigliozzi erklärt, die den Großteil der Studie in Zusammenarbeit mit Wiedemann durchgeführt hat.
„Unsere Ergebnisse deuten darauf hin, dass IL1B eine wichtige Rolle bei der Verknüpfung sensorischer Informationen, wie dem Anblick und Geruch einer Mahlzeit, mit der anschließenden neural vermittelten Insulinsekretion und bei der Regulierung dieser Verbindung spielt“, fasst Marc zusammen. Donath.
Schlussfolgerungen Zusammenfassend schreiben unsere Ergebnisse IL-1β eine regulatorische Rolle bei der Integration nährstoffbezogener sensorischer Informationen, der anschließenden neuronenvermittelten Insulinsekretion und der Fehlregulation autonomer Kopfphasenreaktionen bei Fettleibigkeit zu. Dies identifiziert einen neuroimmunologischen endokrinen Schaltkreis bei der Regulierung der Insulinsekretion. |
















