Punti salienti
|
Riepilogo
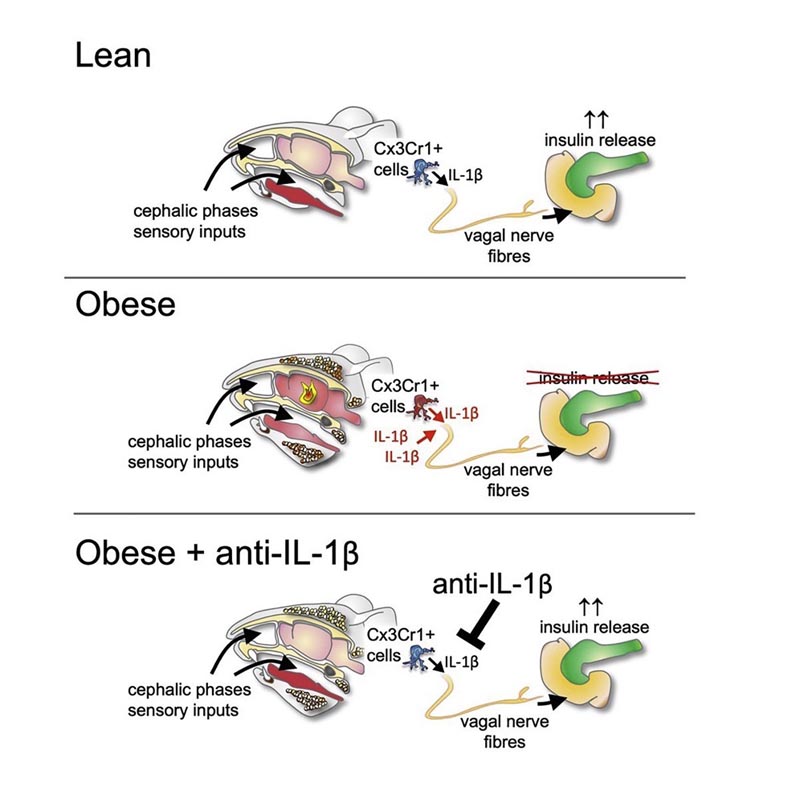
La fase cefalica iniziale della secrezione di insulina è mediata dal nervo vago e non è dovuta alla stimolazione glicemica delle cellule β pancreatiche. Recentemente, è stato dimostrato che IL-1β stimola la secrezione di insulina postprandiale. Qui, descriviamo che questo effetto simile alle incretine di IL-1β coinvolge la trasmissione neuronale . Inoltre, abbiamo scoperto che il rilascio di insulina nella fase cefalica era mediato da IL-1β della microglia. Inoltre, IL-1β ha attivato il nervo vago per indurre la secrezione di insulina e regolare l’attività dell’ipotalamo in risposta alla stimolazione della testa. In particolare, il rilascio di insulina nella fase cefalica era compromesso nell’obesità , sia nei topi che nell’uomo, e nei topi ciò era dovuto alla segnalazione disregolata di IL-1β. I nostri risultati attribuiscono un ruolo regolatore all’IL-1β nell’integrazione delle informazioni sensoriali derivate dai nutrienti, nella successiva secrezione di insulina mediata dai neuroni e nella disregolazione delle risposte della fase cefalica autonomica nell’obesità.
La secrezione di insulina è regolata da molteplici fattori. Sebbene gli effetti diretti dell’azione del glucosio sulle cellule β pancreatiche costituiscano lo stimolo più importante della secrezione di insulina, altri meccanismi, come la stimolazione neuronale e gli ormoni incretinici , possono spiegare fino al 70%-80% della risposta totale. di insulina ad un pasto.
Il rilascio di insulina nella fase cefalica è la conseguenza degli stimoli sensoriali provenienti dal cibo (vista, olfatto, gusto, stimolazione propriocettiva e tattile) che agiscono sui recettori della testa e dell’orofaringe prima degli effetti stimolanti diretti del glucosio. nelle cellule β.
Questi stimoli comportano quindi l’attivazione del sistema nervoso parasimpatico e la secrezione di insulina a valle. Le risposte della fase cefalica sono essenziali nella regolazione postprandiale dell’omeostasi del glucosio perché un pasto che bypassa la cavità orale e quindi le risposte della fase cefalica causano intolleranza al glucosio . A parte la segnalazione dei recettori muscarinici nelle cellule β e nelle monoammine ipotalamiche, fino ad oggi non è stato descritto alcun mediatore molecolare del rilascio di insulina nella fase cefalica.
L’interleuchina 1 beta (IL-1β) regola la risposta del corpo ai danni tissutali e agli agenti patogeni. Più recentemente, IL-1β ha dimostrato di essere un attore essenziale sia nella fisiologia che nella patologia del metabolismo del glucosio. Infatti, l’attivazione cronica di IL-1β nei pazienti con sindrome metabolica promuove la tossicità delle cellule β e, in definitiva, il fallimento, segni distintivi del diabete di tipo 2 . In contrasto con questi effetti deleteri a lungo termine , l’assunzione acuta di cibo innesca le cellule mieloidi a produrre IL-1β, che poi contribuisce alla fisiologica stimolazione postprandiale della secrezione di insulina. Tuttavia, i meccanismi alla base di questo effetto incretino-simile dell’IL-1β sul rilascio di insulina rimangono sconosciuti.
Ipotizziamo che IL-1β eserciti il suo effetto secretagogo sulla secrezione di insulina attraverso la stimolazione del sistema nervoso parasimpatico . Utilizzando modelli genetici e farmacologici, abbiamo scoperto che IL-1β media il suo effetto stimolatorio sulla secrezione di insulina attraverso la segnalazione muscarinica centrale. Per corroborare il coinvolgimento neuronale del rilascio di insulina mediato da IL-1β, abbiamo studiato la risposta insulinica in fase cefalica come eccellente esempio di secrezione di insulina mediata a livello centrale. Abbiamo identificato IL1β come mediatore cruciale di questo riflesso della fase cefalica. Originato da cellule mieloidi CX3CR1+ a lunga vita, come la microglia, regola l’attività neuronale nell’ipotalamo in risposta alla stimolazione della testa. In particolare, abbiamo scoperto che il rilascio di insulina nella fase cefalica è compromesso nell’obesità , sia nei topi che nell’uomo, in modo IL-1β-dipendente nei topi. Pertanto, IL-1β ha un ruolo regolatore nella stimolazione neuronale della secrezione di insulina e nella deregolamentazione delle risposte autonome della fase cefalica nell’obesità.
Commenti
Anche prima che i carboidrati raggiungano il flusso sanguigno, la semplice vista e l’odore di un pasto innescano il rilascio di insulina . I ricercatori dell’Università di Basilea e dell’Ospedale universitario di Basilea hanno dimostrato per la prima volta che il rilascio di insulina dipende da una risposta infiammatoria a breve termine che si verifica in queste circostanze. Tuttavia, negli individui in sovrappeso , questa risposta infiammatoria è così eccessiva da poter influenzare la secrezione di insulina.
Anche l’anticipazione di un pasto imminente innesca una serie di risposte nel corpo, forse la più familiare delle quali è la saliva in bocca. Ma anche l’ormone insulina , che regola lo zucchero nel sangue, entra in gioco prima ancora di dare il primo morso. Gli esperti la chiamano fase neuromediata (o cefalica) della secrezione di insulina.
Il cibo stimola le difese immunitarie
In passato, però, non era chiaro come la percezione sensoriale di un pasto generasse un segnale al pancreas per aumentare la produzione di insulina. Ora i ricercatori dell’Università di Basilea e dell’Ospedale universitario di Basilea hanno identificato un importante pezzo del puzzle: un fattore infiammatorio noto come interleuchina 1 beta (IL1B), che è coinvolto anche nella risposta immunitaria agli agenti patogeni o ai danni ai tessuti. . Il team ha riportato i risultati sulla rivista Cell Metabolism .
"È sorprendente il fatto che questo fattore infiammatorio sia responsabile di una parte considerevole della normale secrezione di insulina in individui sani , perché è coinvolto anche nello sviluppo del diabete di tipo 2", spiega il professor Marc Donath, responsabile dello studio. , del Dipartimento di Biomedicina ed Endocrinologia Clinica.
Conosciuto anche come “diabete dell’adulto ”, questa forma di diabete è causata da un’infiammazione cronica che danneggia, tra le altre cose, le cellule del pancreas produttrici di insulina. Questa è un’altra situazione in cui IL1B gioca un ruolo chiave; in questo caso viene prodotto e secreto in quantità eccessivamente elevate. Con questo in mente, gli studi clinici stanno ora esaminando se gli inibitori contro questo fattore infiammatorio sono adatti per l’uso come agenti terapeutici per il diabete.
Risposta infiammatoria di breve durata
Le circostanze sono diverse quando si tratta della secrezione di insulina mediata dai neuroni: "L’odore e la vista di un pasto stimolano specifiche cellule immunitarie nel cervello conosciute come microglia ", afferma l’autrice dello studio Dr. Sophia Wiedemann, un medico residente. di medicina interna. “Queste cellule secernono brevemente IL1B, che a sua volta influenza il sistema nervoso autonomo attraverso il nervo vago ”. Questo sistema trasmette poi il segnale al sito di secrezione dell’insulina, cioè al pancreas.
Tuttavia, in caso di obesità patologica , questa fase della secrezione di insulina mediata dal sistema nervoso viene interrotta . Nello specifico, a causa dell’eccessiva risposta infiammatoria iniziale, come ha spiegato la dottoranda Kelly Trimigliozzi, che ha condotto gran parte dello studio in collaborazione con Wiedemann.
“I nostri risultati indicano che IL1B svolge un ruolo importante nel collegare le informazioni sensoriali, come la vista e l’olfatto di un pasto, alla successiva secrezione di insulina mediata dai neuroni e nella regolazione di questa connessione”, riassume Marc. Donath.
Conclusioni In sintesi, i nostri risultati attribuiscono un ruolo regolatore all’IL-1β nell’integrazione delle informazioni sensoriali derivate dai nutrienti, nella successiva secrezione di insulina mediata dai neuroni e nella disregolazione delle risposte della fase cefalica autonomica nell’obesità. Ciò identifica un circuito endocrino neuroimmunologico nella regolazione della secrezione di insulina. |
















