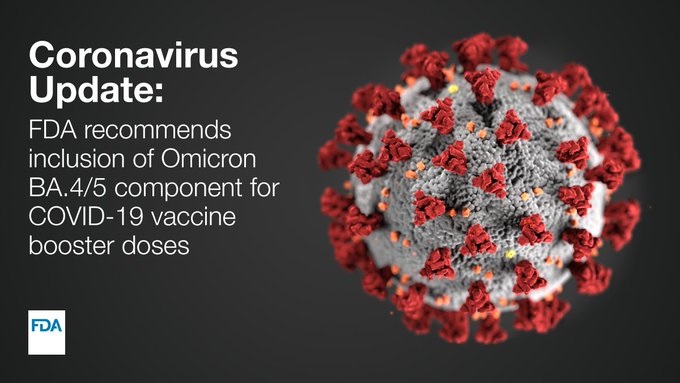
Mise à jour de la FDA sur le coronavirus (COVID-19) :
Des experts indépendants du comité consultatif sur les vaccins et les produits biologiques associés de la Food and Drug Administration des États-Unis se sont réunis pour discuter publiquement de la nécessité de modifier la composition actuelle des souches des vaccins contre la COVID-19 pour les doses de rappel pour les saisons d’automne et d’hiver 2022.
Les vaccins contre le COVID-19 que la FDA a approuvés et autorisés pour une utilisation d’urgence ont fait une énorme différence en matière de santé publique et ont sauvé d’innombrables vies aux États-Unis et dans le monde. Cependant, le SRAS-CoV-2, le virus responsable du COVID-19, a considérablement évolué, avec des poussées récentes dans le monde associées à la propagation rapide de variantes hautement transmissibles comme Omicron.
Les vaccins actuellement disponibles ont contribué à réduire les conséquences les plus graves (hospitalisations et décès) causées par le COVID-19, mais les résultats des études observationnelles post-homologation ont montré que l’efficacité de la primo-vaccination diminue avec le temps contre certains variants, dont Omicron . Et bien que les premières doses de rappel aient contribué à restaurer la protection contre les maladies graves et les hospitalisations associées à Omicron, des études ont également indiqué une diminution de l’efficacité des premières doses de rappel au fil du temps.
Le public américain peut être assuré que tout vaccin contre le COVID-19 autorisé ou approuvé par la FDA répondra à nos normes de sécurité et d’efficacité. En attendant, nous encourageons ceux qui sont actuellement éligibles à un rappel à en obtenir un.
À l’approche de l’automne et de l’hiver, il est essentiel que nous disposions de rappels de vaccins sûrs et efficaces, capables de fournir une protection contre les variants en circulation et émergents afin de prévenir les conséquences les plus graves de la COVID-19. Après de longues discussions le 28 juin 2022, une écrasante majorité du comité consultatif a voté en faveur de l’inclusion d’un composant Omicron du SRAS-CoV-2 dans les vaccins contre la COVID-19 qui seraient utilisés comme rappel aux États-Unis. .à partir de l’automne 2022.
À la suite du vote, et en nous efforçant d’utiliser les meilleures preuves scientifiques disponibles, nous avons conseillé aux fabricants souhaitant mettre à jour leurs vaccins contre la COVID-19 de développer des vaccins modifiés qui ajoutent un composant protéique de pointe omicron BA.4/5 à la composition actuelle du vaccin pour créer un vaccin de rappel à deux composants (bivalent), afin que des vaccins modifiés puissent potentiellement être utilisés du début à la mi-automne 2022.
Comme nous nous attendons à ce que l’année prochaine soit une période de transition au cours de laquelle ce vaccin de rappel modifié pourra être introduit, nous n’avons pas conseillé aux fabricants de passer à la primo-vaccination, car une série primaire avec les vaccins autorisés contre la COVID-19 et les vaccins approuvés par la FDA constitue une base. de protection contre les conséquences graves du COVID-19 causées par les souches circulantes du SRAS-CoV-2.
Les fabricants de vaccins ont déjà communiqué des données d’essais cliniques avec des vaccins modifiés contenant un composant Omicron BA.1 et nous leur avons conseillé de soumettre ces données à la FDA pour notre évaluation avant toute autorisation potentielle d’un vaccin modifié contenant un composant Omicron. BA. Il sera également demandé aux fabricants de commencer des essais cliniques avec des vaccins modifiés contenant un composant Omicron BA 4/5, car ces données seront utiles à mesure que la pandémie évolue.
La FDA a prévu la possibilité que les vaccins devront être modifiés pour lutter contre les variantes en circulation et a déjà fourni des conseils à l’industrie sur la manière de le faire efficacement. Comme cela a été le cas pour tous les vaccins contre le COVID-19 pendant la pandémie, l’agence évaluera toutes les données pertinentes pour éclairer la sécurité, l’efficacité et la qualité de fabrication des vaccins modifiés envisagés pour autorisation ou approbation afin de garantir qu’ils répondent aux normes de la FDA.
Conformément à notre engagement en matière de transparence, la FDA communiquera les plans futurs liés à l’autorisation potentielle ou à l’approbation de doses de rappel du vaccin COVID-19 avec un composant Omicron.