Présentation d’un cas • Une femme de 21 ans ayant des antécédents de dépression et d’anxiété se présente au cabinet pour un suivi, référée par les urgences où elle a été soignée il y a 2 jours pour une sensation « d’évanouissement » lors de sa participation à une compétition sportive. correspondre. • Aux urgences, un ionogramme sérique a montré une hypokaliémie de 2,9 mEq/L (plage de référence 3,7 à 5,1 mEq/L), du bicarbonate à 35 Eq/L (22 à 30 mEq/L) et une hypotension orthostatique. • Le patient a reçu 2 litres de solution saline isotonique par voie intraveineuse et du potassium (k+) par voie intraveineuse et orale. Au suivi, ses signes vitaux étaient normaux et son indice de masse corporelle est de 24,5 kg/m2. Elle dit se sentir mieux, mais elle a remarqué un gonflement marqué des deux membres inférieurs, ce qui lui cause de la détresse. • L’examen physique révèle 2+ œdèmes piquants et callosités sur le dos de la main droite. |
| Une maladie mentale grave avec des conséquences physiques |
La boulimie mentale (BN) est une maladie mentale grave caractérisée par une frénésie alimentaire suivie de comportements purgatifs compensatoires. Elle s’accompagne souvent de séquelles médicales qui affectent le fonctionnement physiologique normal et contribuent à des taux plus élevés de morbidité et de mortalité.
La plupart des personnes atteintes de boulimie mentale ont un poids normal ou sont en surpoids.
Souvent, les personnes atteintes de BN parviennent à éviter la détection de leur trouble de l’alimentation. Par conséquent, il est important que les cliniciens se familiarisent avec ces complications et sachent identifier les patients présentant des types de troubles de l’alimentation.
> Des crises de boulimie récurrentes suivies de purges
La BN se caractérise par une surévaluation du poids et de la forme du corps et par des crises de boulimie récurrentes (consommation d’une quantité excessive de calories sur une courte période, généralement une période de 2 heures, que le patient se sent incapable de contrôler).
Ceci s’accompagne bientôt de comportements de purge compensatoires, qui peuvent inclure l’abus de laxatifs et de diurétiques, l’omission de l’injection d’insuline (diaboulimie ou trouble de l’alimentation - diabète sucré de type 2), des vomissements provoqués, le jeûne et un exercice physique excessif. Certains patients abusent également de caféine ou de médicaments stimulants, couramment prescrits pour traiter le trouble déficitaire de l’attention/hyperactivité.
Les vomissements provoqués et l’abus de laxatifs représentent plus de 90 % des comportements purgatifs. Le Manuel diagnostique et statistique des troubles mentaux, 5e éd. (DSM-5) nécessite des épisodes de frénésie alimentaire et de comportements compensatoires, survenant au moins 1 fois/semaine sur une période de 3 mois, et ne se produisant pas lors d’un épisode d’anorexie mentale. . Les complications des comportements purgatifs présents dans la BN sont identiques à celles du sous-type anorexie mentale avec hyperpurge et non avec l’anorexie mentale avec restriction, principalement calorique, sans perte de poids excessive.
La gravité de la BN est déterminée par la fréquence modale des comportements de purge (légers, en moyenne 1 à 3 épisodes de purge compensatoires par semaine ; modérés, 4 à 7 ; sévères, 8 à 13 ; extrêmes, ≥ 14) ou par le degré de fonctionnalité. déficience. Certains patients peuvent vomir plusieurs fois par jour, tandis que d’autres peuvent utiliser des quantités importantes de laxatifs.
Certains peuvent pratiquer plusieurs comportements de purge. L’exercice est considéré comme excessif s’il interfère avec d’autres activités, s’il persiste malgré des blessures ou des complications médicales, ou s’il est pratiqué à des moments ou dans des situations inappropriés.
| Cela commence à l’adolescence et est assez courant |
Le BN se développe généralement chez les adolescents ou les jeunes adultes. Elle touche les deux sexes, même si elle est beaucoup plus fréquente chez les filles et les jeunes femmes. Cette pathologie ne dépend pas de l’orientation sexuelle de la personne, mais il a été démontré qu’elle est plus répandue chez les hommes non hétérosexuels.
La recherche a révélé une prévalence similaire du BN parmi différents groupes raciaux et ethniques. Les personnes atteintes de BN se situent généralement dans la fourchette de poids normale ou au-dessus. Selon les données regroupées de l’OMS, la prévalence au cours de la vie du BN chez les adultes est de 1,0 %, en utilisant les critères majeurs du DSM-IV. Ce niveau de prévalence est supérieur à la prévalence de l’anorexie mentale. Les estimations de prévalence sont plus élevées en utilisant les critères élargis du DSM-5, allant de 4 % à 6,7 %.
Il existe de multiples facteurs prédisposants et perpétuants : génétiques, environnementaux, psychosociaux, neurobiologiques et capricieux. Ceux-ci peuvent inclure l’impulsivité ; les transitions développementales, telles que la puberté ; internalisation de l’idéal de minceur et préoccupations concernant le poids et la forme du corps. Des antécédents de traumatismes infantiles, notamment des traumatismes sexuels, physiques ou émotionnels, ont également été associés au BN.
Plus de 70 % des personnes souffrant de troubles de l’alimentation rapportent des comorbidités psychiatriques : troubles affectifs, anxiété, toxicomanie et troubles de la personnalité. Les comorbidités psychiatriques ainsi que le désespoir, la honte et l’impulsivité associés à la maladie peuvent contribuer aux défis liés à l’automutilation non suicidaire, aux idées suicidaires et à la mort par suicide.
Les personnes atteintes de BN connaissent des taux d’automutilation non suicidaires de 33 % au cours de leur vie et sont près de 8 fois plus susceptibles de se suicider que la population générale. Les taux de mortalité chez les personnes atteintes de BN sont inférieurs à ceux atteints d’anorexie mentale, mais restent néanmoins élevés, entre 1,5 % et 2,5 %.
| Complications médicales |
Le BN est associé à un taux de mortalité significativement plus élevé, même si la plupart des patients sont jeunes.
Une grande partie de cette mortalité élevée est imputable aux complications médicales associées, qui sont le résultat direct du mode et de la fréquence des comportements de purge. Ainsi, par exemple, si quelqu’un utilise des laxatifs 3 fois par jour ou vomit 1 fois par jour, il se peut qu’il n’y ait aucune complication médicale, mais de nombreux patients pratiquent leurs comportements de purge plusieurs fois par jour, ce qui entraîne de multiples complications.
Outre les perturbations électrolytiques résultant de la purge, d’autres complications médicales dépendent du mode particulier de purge. D’un autre côté, il a été prouvé que le BN augmente le risque de toute maladie cardiovasculaire, y compris les cardiopathies ischémiques et la mort chez les femmes. Ces mêmes complications peuvent également être observées chez les patients souffrant d’anorexie mentale qui subissent des purges excessives, contrairement à ceux souffrant d’anorexie mentale qui limitent uniquement leur apport calorique, sans recourir à la purge.
| Fourrure |
> Le signe de Russell 
Le signe de Russell a été défini pour la première fois dans le BN par le Dr Gerald Russell en 1979 et fait référence au développement de callosités sur la face dorsale de la main dominante. Elle est pathognomonique des vomissements auto-provoqués et est due à une irritation traumatique de la main par les dents, due à l’insertion répétée de la main dans la bouche pour provoquer des vomissements. Ce signe n’apparaît pas chez les patients qui peuvent vomir spontanément ou qui utilisent des ustensiles pour faire vomir.
| Dents et bouche |
Les anomalies des dents et de la bouche spécifiques aux purges par vomissements comprennent les érosions et les traumatismes de la muqueuse buccale et du pharynx. L’érosion dentaire est la manifestation buccale la plus courante de la régurgitation chronique.
On pense qu’elle est causée par le contact des dents avec des vomissures acides (pH 3,8), bien que l’on ne sache pas clairement comment la composition de la salive est modifiée et comment elle contribue à l’apport alimentaire. Elle a tendance à affecter les surfaces linguales des dents maxillaires et est connue sous le nom de périmyolyse.
Les vomissements augmentent également potentiellement le risque de carie dentaire. Il peut également y avoir des signes de traumatisme au niveau de la muqueuse buccale, en particulier au niveau du pharynx et du palais mou, et il est probable que cela se produise à la suite de l’introduction par le patient d’un corps étranger dans la bouche pour provoquer des vomissements, ou à cause de l’effet caustique du vomissements sur la muqueuse.
Une fois développées, les érosions dentaires sont irréversibles. Après la purge, l’utilisation d’un bain de bouche fluoré et un brossage horizontal doux sont recommandés. Les vomissements provoqués continuellement endommagent également les dents et les prothèses nouvellement implantées.
| Tête, oreilles, nez et gorge |
La purge par vomissements augmente le risque d’hémorragies sous-conjonctivales dues à des haut-le-cœur sévères, qui peuvent également provoquer des épistaxis récurrentes. En fait, des épisodes récurrents d’épistaxis qui restent inexpliqués devraient faire suspecter un BN secret.
La pharyngite est généralement observée chez ceux qui vomissent fréquemment, en raison du contact du tissu pharyngé avec l’acide gastrique. Un enrouement, une toux et une dysphagie peuvent également se développer. L’inconfort pharyngé et laryngé peut être amélioré en arrêtant les vomissements et en utilisant des médicaments pour supprimer la production d’acide, tels que les inhibiteurs de la pompe à protons (IPP).
| glandes parotides |
Plus de 50 % des personnes ayant des comportements purgatifs par vomissements volontaires présentent une hypertrophie de la glande parotide ou une sialadénose .
> Salidénose
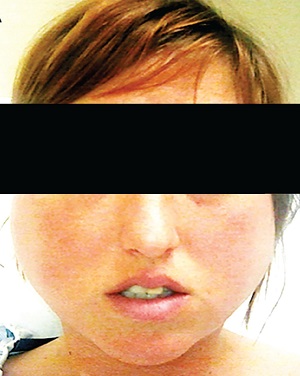
Il est à noter que cette hypertrophie se développe généralement 3 à 4 jours après l’arrêt des purges. Les symptômes sont une hypertrophie bilatérale indolore de la glande parotide et parfois d’autres glandes salivaires. On pense que cela est dû à une stimulation cholinergique des glandes ; l’hypertrophie glandulaire pour satisfaire les exigences de l’hypersalivation ou la réserve excessive de salive qui, lorsque les vomissements cessent, n’est plus nécessaire. L’étude histopathologique révèle une hypertrophie des cellules acineuses avec préservation du reste de l’architecture, sans signes d’inflammation.
L’enflure peut disparaître avec l’arrêt de la purge. La diminution partielle de l’hypertrophie glandulaire suggère fortement que la purge se poursuit. La sialadénose a également tendance à se résoudre avec l’utilisation de sialagogues tels que les bonbons acidulés, les coussins chauffants et les anti-inflammatoires non stéroïdiens, qui ont également un rôle thérapeutique et devraient peut-être être initiés à titre prophylactique chez les personnes ayant de longs antécédents de vomissements. excessive et subissent un traitement pour arrêter la purge. Dans de rares cas réfractaires, la pilocarpine peut être utilisée judicieusement pour ramener les glandes à leur taille normale.
| Cardiovasculaire |
Les complications cardiaques spécifiques de la purge comprennent des troubles électrolytiques dus à des vomissements et à l’abus de diurétiques ou de laxatifs.
Ces troubles s’accompagnent également d’arythmies cardiaques graves et d’un allongement de l’intervalle QT, notamment du fait d’une hypokaliémie et de troubles acido-basiques. L’ingestion excessive d’ipéca, qui contient l’alcaloïde cardiotoxique émétine, utilisé pour provoquer des vomissements, peut provoquer divers troubles de la conduction et une cardiomyopathie potentiellement irréversible.
L’abus de caféine ou de médicaments stimulants, utilisés pour traiter le trouble déficitaire de l’attention/hyperactivité, peut provoquer des palpitations, une tachycardie sinusale ou des arythmies telles que la tachycardie supraventriculaire. De même, les pilules amaigrissantes, dont l’utilisation a augmenté dans cette population, sont associées à des arythmies.
| Pulmonaire |
Les haut-le-cœur provoqués par les vomissements augmentent les pressions intrathoraciques et intra-alvéolaires, ce qui peut conduire à un pneumomédiastin . Cette pathologie est due à une rupture alvéolaire non traumatique dans un contexte de malnutrition et est donc non spécifique et ne permet pas de différencier les patients qui purgent de ceux qui se restreignent.
Les vomissements augmentent également le risque de pneumonie par aspiration , qui pourrait être impliquée dans la pathogenèse jusqu’ici énigmatique de l’ infection pulmonaire à complexe Mycobacterium avium .
| Gastro-intestinal |
Les complications gastro-intestinales dépendent du mode de purge utilisé. Des complications gastro-intestinales supérieures se développent chez ceux qui provoquent des vomissements, tandis que des complications gastro-intestinales inférieures apparaissent chez ceux qui abusent de laxatifs stimulants.
> Complications œsophagiennes
Des vomissements excessifs exposent l’œsophage à l’acide gastrique et à des lésions du sphincter inférieur de l’œsophage, augmentant ainsi la susceptibilité au reflux gastro-œsophagien et à d’autres complications œsophagiennes, notamment l’œsophage de Barrett et l’adénocarcinome œsophagien. Cependant, il n’est pas clair s’il s’agit véritablement d’une association entre la purge provoquée par des vomissements volontaires et le reflux gastro-œsophagien.
Bien que les recherches indiquent que chez les patients qui purgent, la majorité des complications gastro-intestinales sont dues à un reflux, et que cela peut se produire lorsque ceux qui purgent sont évalués par surveillance du pH, les résultats endoscopiques ne sont pas nécessairement en corrélation avec la gravité des symptômes. Ceci suggère une possible composante fonctionnelle dans les complications liées au reflux gastro-intestinal.
En guise de traitement, l’arrêt des purges est recommandé, bien que les IPP puissent être essayés. Le métoclopramide peut également être bénéfique, en raison de son action consistant à accélérer la vidange gastrique et à augmenter le tonus du sphincter œsophagien inférieur. Si les symptômes persistent ou sont présents depuis longtemps, l’endoscopie est indiquée pour rechercher des anomalies précancéreuses de la muqueuse œsophagienne, comme cela se produit avec l’œsophage de Barrett.
La rupture de l’œsophage , connue sous le nom de syndrome de Boerhaave, et les déchirures de Mallory-Weiss sont des complications rares pouvant provoquer des saignements du tractus gastro-intestinal supérieur, à la suite d’épisodes récurrents de vomissements.
Les larmes de Mallory-Weiss se présentent généralement sous la forme de vomissements striés de sang ou sanglants ou de vomissements ressemblant à du marc de café après des épisodes de vomissements récurrents. La perte de sang due à ces larmes est généralement minime. À l’endoscopie, les déchirures de Mallory-Weiss apparaissent sous forme de lacérations longitudinales de la muqueuse.
> Inertie colique
Les personnes qui utilisent des quantités excessives de laxatifs stimulants, et leur abus chronique, peuvent courir un risque de « côlon cathartique », une condition dans laquelle le côlon devient un tube inerte, incapable d’évacuer les selles. On pense que cela est dû à des dommages directs au plexus nerveux myentérique.
Cependant, à l’heure actuelle, il est douteux que cette maladie se développe réellement chez les personnes souffrant de troubles de l’alimentation et utilisant des laxatifs stimulants. Quoi qu’il en soit, en général, les laxatifs stimulants ne doivent être utilisés qu’à court terme, pour éviter cette complication potentielle, et doivent être arrêtés chez les personnes qui développent cette maladie. En revanche, pour gérer la constipation, les laxatifs osmotiques peuvent être prescrits de manière mesurée, puisqu’ils ne stimulent pas directement le péristaltisme.
La mélanose coli est une décoloration noire du côlon sans signification clinique connue, souvent rapportée lors d’une coloscopie chez ceux qui abusent de laxatifs stimulants.
Un prolapsus rectal peut également se développer chez ceux qui abusent de laxatifs stimulants, mais il n’est pas spécifique à ce mode de purge, car il peut également se développer uniquement à la suite d’une malnutrition et d’une faiblesse des muscles du plancher pelvien.
| Endocrine |
Une complication endocrinienne possible de la BN est le cycle menstruel irrégulier, comparé à l’aménorrhée fréquemment observée dans les sous-types de contention et de purge excessive d’anorexie mentale. Bien que les patients atteints de BN ne semblent pas présenter un risque significativement accru de déminéralisation osseuse, comme cela se produit chez les patients qui limitent leurs calories.
Chez les personnes ayant des antécédents d’anorexie mentale avec hyperpurge, il est conseillé de réaliser une densitométrie osseuse par absorptiométrie à rayons X bi-énergie. Les patients atteints de diabète sucré de type 1 peuvent manipuler leur glycémie afin d’évacuer les calories, une affection précédemment appelée diabète sucré de type 1 (anciennement connue sous le nom de diaboulimie). Ces patients courent un risque d’hyperglycémie marquée, d’acidocétose et de complications microvasculaires prématurées telles que la rétinopathie et la neuropathie.
| Altérations métaboliques et électrolytiques |
En plus des complications mentionnées ci-dessus, chacune des méthodes de purge utilisées par les patients atteints de BN peut être associée à des perturbations électrolytiques spécifiques. Ces altérations sont probablement la cause de décès la plus proche chez les patients atteints de BN. Lorsqu’un patient utilise simultanément plusieurs modes de comportement de purge et que sa maladie psychiatrique s’aggrave, les électrolytes peuvent également être altérés.
Les profils d’altération des électrolytes peuvent se chevaucher et être plus extrêmes. Pour les patients ayant des antécédents de comportements de purge connus, les électrolytes doivent être évalués fréquemment, voire quotidiennement, en fonction de la fréquence de leurs comportements de purge, le plus courant étant les vomissements auto-induits.
Les patients qui purgent avec des vomissements provoqués ou un abus de diurétiques, ou les deux, présentent une hypokaliémie, une hypochlorémie et une alcalose métabolique. La gravité des anomalies électrolytiques s’aggrave avec la fréquence des vomissements. De même, l’abus de laxatifs entraîne également une hypokaliémie et une hypochlorémie. Cependant, ils peuvent présenter une acidose métabolique sans trou anionique ni alcalose métabolique, en fonction de la chronicité de l’abus de laxatifs.
En général, la diarrhée chronique entraîne une alcalose métabolique. Une hyponatrémie peut également être présente avec ces 3 comportements de purge. Dans ces cas, le résultat le plus courant est une hyponatrémie de type hypovolémique due à une déplétion liquidienne chronique résultant de comportements de purge.
> Physiopathologie de l’hypokaliémie et de l’hypochlorémie
Les causes physiopathologiques de l’hypokaliémie et de l’hypochlorémie sont observées quel que soit le comportement de purge. La première, et la plus évidente, est qu’il y a une perte de K+ dans le contenu gastrique purgé, des selles excessives résultant d’un abus de laxatifs ou de l’urine due à un abus de diurétiques.
Deuxièmement, une purge chronique entraîne une déplétion liquidienne, qui est détectée par l’artériole afférente du rein comme une diminution de la pression de perfusion rénale, qui à son tour active le système rénine-angiotensine-aldostérone, entraînant une production accrue d’aldostérone par la zone glomérulaire du glandes surrénales. L’aldostérone agit sur les tubules contournés distaux et les canaux collecteurs corticaux, réabsorbant ainsi le sodium (Na+) et le chlorure (Cl-) dans la tentative du corps de prévenir une déshydratation grave, une hypotension et un évanouissement.
L’aldostérone favorise également la sécrétion rénale de K+ dans l’urine, provoquant ainsi une hypokaliémie. Ce mécanisme de perte de K+ est en réalité un contributeur majeur à l’hypokaliémie, plutôt que les pertes gastro-intestinales ou urinaires.
Concernant l’abus de diurétiques, ces médicaments, à eux seuls, agissent directement sur le rein pour favoriser la perte de NaCl urinaire, entraînant une hypovolémie et une sécrétion d’aldostérone. Il en résulte une perte urinaire d’hydrogène (H+) et de K+, provoquant une alcalose métabolique. Cependant, les diurétiques épargneurs de potassium tels que la spironolactone ne précipitent pas l’alcalose métabolique, car ils inhibent l’action de l’aldostérone dans les reins.
Tableau 1
| Comportement | Potassium | Sodium | base acide | |
|
Faible | Faible ou normal | alcalose métabolique | |
|
Faible | Faible ou normal | Alcalose métabolique ou acidose sans trou anionique | |
| Abus de diurétiques | Faible | Faible ou normal | alcalose métabolique |
| Syndrome de pseudo-Bartter |
Les résultats hydroélectrolytiques susmentionnés dus à l’activation du système rénine-angiotensine-aldostérone sont connus sous le nom de syndrome de pseudo-Bartter, en raison des résultats sériques et histochimiques de la biopsie rénale, qui ressemblent à ceux du syndrome de Bartter. Cependant, ces constatations ne sont pas dues à une pathologie rénale intrinsèque mais plutôt à un état de déshydratation chronique, dû à un comportement purgatif.
L’augmentation du niveau d’aldostérone qui résulte des comportements de purge et qui fait partie intégrante du syndrome de pseudo-Bartter, lorsque les comportements de purge s’arrêtent brusquement, peut conduire à un œdème. La raison en est que les taux sériques d’aldostérone restent élevés, provoquant une rétention de sel et d’eau, même si le patient ne perd plus de liquide, puisque la purge a cessé.
| Évaluation et prise en charge des troubles électrolytiques et du syndrome de pseudo-Bartter |
Il est important de suspecter des comportements de purge secrets chez les jeunes femmes par ailleurs en bonne santé qui présentent une hypokaliémie sans cause médicale sous-jacente. Cependant, l’hypokaliémie seule n’est pas spécifique des comportements purgatifs.
Si le patient ne signale pas de comportement pur lorsqu’on l’interroge, une aide au diagnostic consiste à prélever un échantillon d’urine pour déterminer le niveau de K+, créatinine, Na+ et Cl-). Un rapport urinaire K+/créatinine <13 peut identifier une hypokaliémie résultant d’une perte gastro-intestinale, d’une utilisation de diurétiques, d’un mauvais apport ou de modifications transcellulaires. Le rapport Na+/Cl- urinaire peut également être calculé.
Les vomissements sont associés à un rapport Na+/Cl- urinaire > 1,6, en cas d’hypokaliémie, tandis que l’abus de laxatifs est associé à un rapport plus faible (0,7). L’hypokaliémie chronique est généralement asymptomatique et peut être corrigée lentement. Si le potassium n’est pas <2,5 mEql/l et que le patient ne présente pas de symptômes physiques ou de modifications électrocardiographiques d’hypokaliémie, l’hypokaliémie peut être contrôlée en arrêtant le comportement de purge et en administrant du potassium par voie orale.
L’observance de l’administration orale d’un supplément de potassium peut être améliorée en utilisant des comprimés de chlorure de potassium au lieu de préparations liquides. Une supplémentation agressive en K+ par voie intraveineuse expose les patients à un risque d’hyperkaliémie et doit être réservée aux taux de potassium extrêmement bas.
Une hypokaliémie sévère (<2,5 mEq/L) nécessite du K+, à la fois par voie orale et intraveineuse. Ce processus de remplacement est facilité par l’administration d’une solution saline isotonique avec du chlorure de potassium par voie intraveineuse à un faible débit de perfusion (50 à 75 ml/heure). Pour corriger l’alcalose métabolique et interrompre l’activation du système rénine-angiotensine-aldostérone, il est nécessaire de corriger la déplétion volémique.
Une hypokaliémie sévère non traitée peut entraîner un intervalle QT corrigé prolongé, avec des torsades de pointes postérieures et d’autres arythmies cardiaques potentiellement mortelles. Corriger simplement l’hypokaliémie sans corriger l’alcalose métabolique n’est pas suffisant, car la perte rénale de K+ se poursuit sous l’action de l’aldostérone rénale. Rarement, l’hypokaliémie chronique est associée à une insuffisance rénale aiguë et à des signes de néphrite interstitielle à la biopsie rénale, appelée néphropathie hypokaliémique.
Une hyponatrémie légère s’auto-corrige souvent en arrêtant les comportements de purge et en pratiquant une réhydratation orale. Cependant, si le Na+ sérique est < 125 mEql/l, une hospitalisation est indiquée, pour une surveillance étroite et une correction lente avec du sérum physiologique isotonique, jusqu’à atteindre des valeurs de perfusion de 4 à 6 mEql/l toutes les 24 heures.
Cela évite la complication grave connue sous le nom de myélinolyse centrale pontique. Si l’hyponatrémie est sévère (Na+ sérique < 118 mEql/l), il est probable que le patient bénéficiera d’une admission en réanimation et d’une consultation de néphrologie, pour envisager l’administration de desmopressine pour éviter une surcorrection.
Une alcalose métabolique peut se développer chez les patients atteints de BN, en raison d’une diminution du volume intravasculaire, d’une aldostérone élevée et d’une hypokaliémie. La plupart du temps, il ne répond pas aux solutions salines.
La valeur du Cl urinaire peut également être utilisée ; si <10 mEq/L, l’alcalose métabolique est hypovolémique et s’améliorera avec le remplacement lent de la solution saline intraveineuse. L’examen physique nous permet également de déterminer le volume de liquide du patient, à la recherche de signes de déshydratation.
En raison du risque sous-jacent de syndrome de pseudo-Bartter chez les patients BN qui arrêtent brusquement leurs comportements de purge, une réanimation liquidienne agressive doit être évitée. L’arrêt du comportement purgatif associé à une réanimation intraveineuse rapide peut entraîner la formation d’un œdème marqué et rapide, accompagné d’une prise de poids, ce qui peut être psychologiquement pénible.
Par conséquent, pour atténuer la formation d’œdème, un faible débit de perfusion de solution saline (50 ml/heure) avec de faibles doses de spironolactone (début : 50 à 100 mg, dose maximale de 200 à 400 mg/jour) doit être utilisé. .
La spironolactone est généralement maintenue pendant 2 à 4 semaines, puis réduite à 50 mg tous les quelques jours. Parfois, chez les patients qui abusent de laxatifs extrêmes, la propension à l’œdème peut persister, nécessitant une administration encore plus lente de spironolactone.
| Complications médicales de la frénésie alimentaire |
La littérature sur les complications de l’hyperphagie boulimique, spécifiques au BN, est limitée. Cependant, les patients souffrant d’hyperphagie boulimique ont tendance à être en surpoids ou obèses car ils ne purgent pas après des épisodes d’hyperphagie boulimique.
Par conséquent, bon nombre des complications médicales de l’hyperphagie boulimique, telles que le diabète de type 2, l’hypertension, la stéatose hépatique non alcoolique et le syndrome métabolique, sont liées à l’obésité. En revanche, de nombreux patients atteints de BN ont un indice de masse corporelle normal.
Par conséquent, il est difficile de déduire que les complications médicales résultant de l’hyperphagie boulimique sont les mêmes que celles qui surviennent dans le BN. Toutefois, l’extrapolation a du sens dans certains cas. Par exemple, les patients qui mangent de façon excessive courent un risque plus élevé de carences, car les aliments consommés pendant une frénésie alimentaire ont tendance à être transformés, riches en graisses et en glucides et pauvres en protéines.
Une alimentation pauvre en vitamines et minéraux, notamment en vitamines A et C, augmente le risque de carences nutritionnelles.
En revanche, les patients souffrant d’hyperphagie boulimique présentent davantage de symptômes gastro-intestinaux : reflux acide, dysphagie et ballonnements, également observés dans le BN. Par conséquent, la frénésie alimentaire peut influencer ces symptômes.
Enfin, plus rarement, une perforation gastrique a été observée lors d’un épisode d’hyperphagie boulimique en raison d’une distension excessive de l’estomac, entraînant une nécrose gastrique. Dans ces cas, une obstruction du canal gastrique due à la formation d’un bézoard alimentaire a également été rapportée.
| Identification et traitement de la santé mentale |
Il a été démontré que le dépistage des troubles de l’alimentation appliqué en soins primaires détecte efficacement les patients présentant ces troubles. Il se compose de 5 questions :
• Êtes-vous satisfait de vos habitudes alimentaires ? (« Non » est considéré comme une réponse anormale). • Mangez-vous parfois en secret ? ("Oui", c’est une réponse anormale que d’arrêter ceci et le reste des questions). • Votre poids affecte-t-il la façon dont vous vous sentez ? • Un membre de votre famille a-t-il souffert d’un trouble de l’alimentation ? • Souffrez-vous actuellement ou avez-vous souffert dans le passé d’un trouble de l’alimentation ? |
Coton et coll. ont constaté qu’au moins 2 réponses anormales avaient une sensibilité de 100 % et une spécificité de 71 % pour les troubles de l’alimentation.
Les traitements standard de santé mentale chez les patients atteints de BN comprennent la stabilisation nutritionnelle et l’interruption du comportement purgatif, la surveillance et la gestion appropriée des complications médicales associées, la prescription de médicaments selon l’indication clinique et les interventions psychothérapeutiques. Le traitement initial recommandé pour le traitement du BN est la thérapie cognitivo-comportementale.
Une méta-analyse récente a guidé l’auto-assistance cognitivo-comportementale et une forme spécifique de thérapie cognitivo-comportementale individuelle pour les troubles de l’alimentation. Ce traitement se poursuit jusqu’à l’obtention d’une rémission complète. Aucun médicament spécifique n’a été développé pour le traitement du BN. Aux États-Unis, le seul médicament approuvé pour le BN est la fluoxétine, un inhibiteur sélectif du recaptage de la sérotonine (SIRS).
Il est administré jusqu’à atteindre la dose cible de 60 mg/jour, qu’il existe ou non des comorbidités. Cette dose réduit la fréquence des crises de boulimie et des épisodes de purge de manière significativement supérieure à 20 mg/jour et au placebo. Il est recommandé aux patients qui ne répondent pas adéquatement aux interventions psychothérapeutiques.
Tableau 2
| La fluoxétine est le seul médicament approuvé par la Food and Drug Administration des États-Unis pour le traitement de la boulimie mentale. |
| L’anxiété et la dépression concomitantes doivent être traitées par thérapie et pharmacologiquement. |
| Les médicaments stimulants n’ont pas été évalués dans le traitement de la boulimie mentale. |
D’autres SIRS ainsi que le topiramate antiépileptique ont montré une efficacité modeste. Le bupropion est contre-indiqué dans le traitement du BN en raison d’un risque accru de convulsions. Aucun essai clinique n’a évalué les médicaments stimulants pour le traitement du BN. Souvent, les médicaments stimulants sont arrêtés jusqu’à ce qu’il y ait une période de retrait des comportements de purge.
Pendant le suivi du sevrage, l’utilisation non conforme de la stimulation pourrait être reconsidérée si le comportement d’hyperphagie boulimique persiste ou si le trouble déficitaire de l’attention avec hyperactivité est comorbide, ou les deux.
En général, un traitement concomitant de l’anxiété ou de la dépression coexistante doit être administré. Les SIRS comme la fluoxétine ciblent également ces symptômes. Si le traitement par fluoxétine échoue, des médicaments de deuxième intention tels que la sertraline ou l’escitalopram peuvent être indiqués. Le citalopram n’est généralement pas utilisé en raison du risque accru d’allongement de l’intervalle QT. La paroxétine n’est pas non plus utilisée en raison de son potentiel de prise de poids.
| Prévision |
Plus le dysfonctionnement psychosocial et la perturbation de l’image corporelle sont importants, plus le risque de rechute est grand.
Chez les patients nécessitant une hospitalisation, plusieurs facteurs prédisent un mauvais résultat, notamment moins d’années de suivi, davantage de tentatives pour perdre du poids, un âge plus avancé au début du traitement et une détérioration plus importante du fonctionnement global.
La guérison est possible, avec des taux de rémission variables, selon le type d’étude et la définition de rémission utilisée (38 % à 42 %, respectivement à 11 et 21 ans. 65 % des individus de l’étude ont été suivis pendant 9 et 22 ans. ans.
| Conclusion |
La boulimie mentale est une maladie psychiatrique complexe entraînant d’innombrables complications médicales, dont certaines peuvent mettre la vie en danger. La plupart de la morbidité et de la mortalité chez les patients atteints de boulimie mentale est le résultat direct des comportements de purge et des troubles électrolytiques et acido-basiques qui en résultent.
Il est donc important que les cliniciens se familiarisent avec ces complications puisque la plupart des patients ont un poids normal et peuvent souvent éviter la détection de leur trouble de l’alimentation.
| Suite du cas présenté |
Lors de la première visite au cabinet, le patient sort sans rendez-vous de suivi ultérieur, sans avoir subi aucune intervention ni analyse biochimique. Le médecin n’a pas trouvé le signe de Russell et a informé le patient que l’œdème était dû aux liquides administrés aux urgences et qu’il se résoudrait tout seul. La patiente a de nouveau eu des comportements purgatifs avec une plus grande vigueur lorsqu’elle a perçu sa prise de poids, conséquence de l’œdème.
Un mois plus tard, elle a subi un épisode de syncope lors d’un autre exercice physique intense, qui a nécessité l’administration de K+ et de solution saline par voie orale et intraveineuse. Lors du suivi, le médecin vérifie l’aggravation de l’œdème et reconnaît le signe de Russell. Les tests de laboratoire révèlent une légère hypokaliémie. Forte de ces constatations, elle demande un dépistage d’un trouble du comportement alimentaire.
Le dépistage est positif et la patiente avoue adopter des comportements purgatifs à travers des vomissements provoqués quotidiennement, un abus de laxatifs stimulants et des épisodes de frénésie alimentaire. Elle est référée au spécialiste des troubles de l’alimentation et commence un traitement avec 40 mmEq/jour de chlorure de potassium, et prévoit des tests de suivi hebdomadaires en laboratoire, jusqu’au début du traitement spécialisé.
















