Résumé La polymyalgie rhumatismale (PMR) est la maladie rhumatismale inflammatoire la plus courante chez les personnes de plus de 50 ans et elle est 2 à 3 fois plus fréquente chez les femmes. Les symptômes les plus courants sont des douleurs matinales et une raideur au niveau de l’épaule et de la ceinture pelvienne. L’apparition peut être aiguë ou se développer sur quelques jours ou semaines. Des symptômes généraux tels que fatigue, fièvre et perte de poids peuvent survenir, probablement causés par la signalisation systémique de l’IL-6. La pathologie comprend l’inflammation synoviale et périarticulaire et la vasculopathie musculaire. Une nouvelle observation est que la PMR peut apparaître comme un effet secondaire du traitement du cancer avec des inhibiteurs de points de contrôle. Le diagnostic de PMR repose principalement sur les symptômes et les signes combinés à des marqueurs de laboratoire de l’inflammation. Les modalités d’imagerie, notamment l’échographie, l’imagerie par résonance magnétique et la tomographie par émission de positons, sont prometteuses dans l’investigation d’une suspicion de RMP. Cependant, ils sont encore limités par la disponibilité, le coût élevé et les performances peu claires du travail de diagnostic. La thérapie aux glucocorticoïdes (GC) est efficace dans la RMP et la plupart des patients répondent rapidement à 15 à 25 mg de prednisolone par jour. La prise en charge des patients atteints de PMR présente des défis, car des rechutes surviennent et les patients atteints de PMR peuvent devoir rester sous GC pendant des périodes prolongées. Ceci est associé à des taux élevés de comorbidités liées aux GC, telles que le diabète et l’ostéoporose, et il existe des données limitées sur l’utilisation de médicaments antirhumatismaux modificateurs de la maladie et de produits biologiques comme agents d’épargne des GC. Enfin, la PMR est associée à une artérite à cellules géantes, qui peut compliquer l’évolution de la maladie et nécessiter un traitement plus intense et plus prolongé. |
| Épidémiologie |
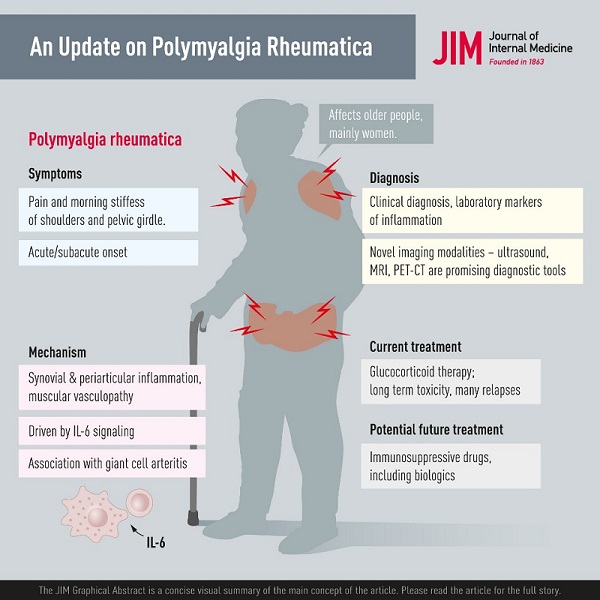
La polymyalgie rhumatismale (PMR) est un trouble rhumatismal associé à des douleurs musculo-squelettiques et à une raideur au niveau du cou, des épaules et de la hanche. L’étiologie n’est pas entièrement comprise, mais des facteurs environnementaux et génétiques sont associés.
L’incidence de la RMP augmente avec l’âge et est rarement observée chez les personnes de moins de 50 ans. Les femmes sont environ 2 à 3 fois plus susceptibles d’être touchées.
La PMR est 2 à 3 fois plus fréquente que l’artérite à cellules géantes (ACG) et survient chez environ 50 % des patients atteints d’ACG. Le PMR peut précéder, accompagner ou suivre l’ACG.
L’incidence est la plus élevée dans les pays scandinaves et chez les personnes d’ascendance nord-européenne. L’incidence et la prévalence estimées de la RMP sont considérablement plus faibles dans d’autres régions du monde, même si tous les groupes raciaux et ethniques peuvent être touchés.
Plusieurs causes potentielles de PMR sont à l’étude. Certaines théories impliquent la variante génétique HLA-DR4. Les sous-types HLA-DR4 ont été associés à la polyarthrite rhumatoïde (PR), et ces allèles sont également présents dans de nombreux cas où PMR et GCA surviennent ensemble. L’apparition soudaine de la RMP et la nature des symptômes tels que douleurs articulaires, fièvre et malaises sont soupçonnées d’être le résultat d’infections causées par des virus.
Les dommages aux artères superficielles dus à une forte exposition au rayonnement ultraviolet du soleil sont une autre cause proposée pour le développement de la PMR. Certaines études suggèrent que les fibres élastiques présentes dans les artères et les membranes synoviales seraient endommagées par les rayons ultraviolets. Ces tissus endommagés peuvent être infectés par des virus qui restent longtemps dormants et peuvent se réactiver plus tard, provoquant une PMR. Son apparition soudaine et la grande variation de son incidence signalée dans diverses régions du monde suggèrent la contribution d’un ou plusieurs agents environnementaux, de facteurs génétiques, ou des deux.
Il a également été suggéré que la PMR et la GCA pourraient être déclenchées par la vaccination contre la grippe saisonnière. Une autre étude a rapporté le premier cas de syndrome de type PMR 7 jours après la vaccination. Cependant, plusieurs études ont rapporté que les symptômes disparaissent généralement rapidement dans de tels cas.
| Pathogenèse et physiopathologie |
Les symptômes typiques de douleur et de raideur musculaires proximales dans la RMP peuvent s’expliquer par une inflammation synoviale et périarticulaire des articulations centrales. Les biopsies de patients PMR non traités ont mis en évidence une synovite avec infiltration de leucocytes (macrophages et lymphocytes T mémoire, et certains lymphocytes B) et une prolifération vasculaire.
De plus, l’activation de l’endothélium vasculaire peut être importante pour la pathogenèse, car une expression accrue du facteur de croissance endothélial vasculaire (VEGF) a été observée dans les biopsies synoviales. Cela pourrait contribuer au recrutement de cellules inflammatoires dans ces lésions. Il a été démontré que le peptide intestinal vasoactif (VIP) est exprimé dans une plus grande mesure dans la membrane synoviale des patients atteints de PMR que chez ceux atteints de PR ou d’arthrose. Il a été suggéré que la nociception liée à la production locale de VIP pourrait contribuer à l’inconfort typique de l’épaule associé à la PMR.
De plus, les examens échographiques ont révélé une bursite sous-acromiale-sous-deltoïdienne et une tendinite du chef long du biceps brachial chez la majorité des patients atteints de RMP. La microscopie par immunofluorescence des biopsies de ce muscle a montré des dépôts de fibrinogène et d’IgA dans la zone périfasciculaire du périmysium. Une microvascularisation musculaire accrue a été observée dans les RMP précoces non traitées.
Il a été démontré que les taux plasmatiques d’IL-6, mais pas de TNF-α, sont élevés dans les cas de GCA et de PMR. La principale source de cette libération d’IL-6 sont les lymphocytes T CD4+. De plus, il a été démontré que les niveaux circulants de récepteur soluble de l’IL-6 prédisent les rechutes futures chez les patients atteints de PMR, soulignant encore l’importance de la signalisation de l’IL-6 dans ce contexte.
Des perturbations des sous-ensembles de lymphocytes T et de lymphocytes B en circulation ont été décrites dans la PMR, mais avec des résultats incohérents. La RMP étant une maladie touchant les personnes âgées, ces tendances peuvent refléter le vieillissement du système immunitaire. Des taux élevés de monocytes dans le sang périphérique ont été observés dans les cas de PMR et d’ACG, avec une diminution significative après le traitement de la PMR, mais pas de l’ACG. Contrairement à de nombreux autres troubles rhumatismaux, aucun auto-anticorps n’a été systématiquement associé à la PMR ou à la GCA. Des preuves combinées soutiennent une interaction entre le système immunitaire cellulaire inné et adaptatif.
Bien qu’il ait été démontré que les caractéristiques métaboliques (IMC plus faible, glycémie à jeun plus faible) susceptibles de contribuer à la régulation immunitaire sont associées au développement ultérieur de la GCA, la relation entre ces facteurs et le risque de PMR n’a pas encore été résolue. n’a pas fait l’objet d’une enquête.
| Présentation clinique et évolution de la maladie |
Une caractéristique de la RMP est l’apparition récente et relativement aiguë de douleurs et de raideurs musculaires proximales au niveau du cou, des épaules, du haut des bras, des hanches et des cuisses. Les patients souffrent souvent d’ une raideur matinale prononcée , avec des difficultés à se lever ou à se lever le matin, avec un certain soulagement spontané des symptômes plus tard dans la journée. La raideur affecte même d’autres activités physiques le matin, comme s’habiller ou effectuer d’autres activités quotidiennes.
Les symptômes se développent généralement complètement en quelques jours à quelques semaines. Parfois, l’apparition est plus insidieuse et peut entraîner des symptômes non spécifiques comme de la fatigue, des arthralgies, une perte d’appétit, un amaigrissement ou de la fièvre. Il n’est pas rare que certains patients subissent des examens en cas de suspicion de malignité avant qu’un diagnostic puisse être posé avec la PMR.
Une présentation clinique non spécifique et l’absence de résultats de laboratoire spécifiques ou de caractéristiques sérologiques entraînent souvent un certain retard dans le diagnostic.
La PMR impose un fardeau important sur la vie quotidienne des personnes âgées. L’impact psychologique est important, notamment l’anxiété liée à la maladie active et les effets secondaires du traitement aux glucocorticoïdes (GC).
| Association avec l’artérite temporale |
La PMR et l’artérite temporale (AT) coexistent souvent, suggérant des facteurs prédisposants communs et des mécanismes pathologiques communs. Étant donné que l’histopathologie typique de l’AT dans les biopsies de l’AT inclut la présence de cellules géantes, la maladie est souvent appelée GCA.
L’artérite à cellules géantes (ACG) est une vascularite systémique qui peut toucher plusieurs gros vaisseaux, souvent, mais pas toujours, y compris l’artère temporale.
Un diagnostic concomitant de GCA doit être suspecté chez un patient atteint de PMR qui présente également des céphalées d’apparition récente, une claudication de la mâchoire, des symptômes visuels nouveaux et inexpliqués ou des symptômes constitutionnels sévères (fièvre d’origine inconnue, perte de poids, fatigue, etc.). De tels symptômes peuvent survenir dès la première présentation de la PMR ou plus tard au cours de l’évolution de la maladie.
Une artérite subclinique peut également survenir chez les patients atteints de PMR. Dans des études systématiques de patients présentant un phénotype clinique typique de PMR, mais sans signes ou symptômes compatibles avec une GCA, des résultats histopathologiques de vascularite dans les biopsies de l’artère temporale ont été trouvés dans jusqu’à 21 % et des caractéristiques échographiques d’AT jusqu’à 32 %. %. La récidive des symptômes de PMR est une caractéristique courante des rechutes de GCA.
| Critères de diagnostic et de classification |
De nombreux critères diagnostiques différents ont été proposés. Le but de ces critères est d’aider les cliniciens à poser le diagnostic de PMR chez chaque patient. La plupart de ces critères sont basés sur les caractéristiques démographiques, cliniques et biologiques de la PMR. Les critères EULAR/ACR sont résumés dans le tableau 1. Les critères de classification sont destinés à être utilisés dans des études épidémiologiques et non à établir un diagnostic chez des patients individuels.
Tableau 1. Critères de classification provisoires EULAR/ACR pour la polymyalgie rhumatismale (modifiés à partir de Dasgupta et al.)
| Critères | Points |
Durée de la raideur matinale > 45 min Douleur à la hanche ou amplitude de mouvement limitée Absence de RF et/ou Anti-CCP Absence d’autre participation conjointe Au moins une épaule présentant une bursite sous-deltoïdienne et/ou une ténosynovite du biceps et/ou une synovite glénohumérale (postérieure ou axillaire) et au moins une hanche présentant une synovite et/ou une bursite trochantérienne Les deux épaules présentent une bursite sous-deltoïdienne, une ténosynovite du biceps ou une synovite glénohumérale |
2 1 2 1 0/1*
0/1* |
| Remarque : Score requis pour la classification de la polymyalgie rhumatismale : 4 ou plus sans échographie et 5 ou plus dans l’algorithme avec échographie. Critères requis : âge ≥ 50 ans, douleurs bilatérales à l’épaule et vitesse de sédimentation anormale de la protéine C-réactive et/ou des érythrocytes. * Sans/avec échographie. Abréviations : Anti-CCP, anticorps anti-peptide citrulliné cyclique ; ACR, Collège américain de rhumatologie ; EULAR, Alliance européenne des associations de rhumatologie ; RF, facteur rhumatoïde. |
|
La sensibilité et la spécificité des critères varient selon que le PMR discrimine toutes les affections, y compris la PR ou les affections affectant les épaules. La sensibilité et la spécificité varient également selon que les ultrasons sont utilisés ou non. Un score ≥4 avait une sensibilité de 68 % et une spécificité de 78 %. Lors de la discrimination des affections de l’épaule dans la PMR, la spécificité est passée à 88 %, alors qu’elle n’était que de 65 % pour la distinction entre la PR et la PMR. En échographie, un score ≥5 avait une sensibilité de 66 % et une spécificité de 81 %.
| Diagnostic |
Il n’existe pas de référence en matière de diagnostic de la RMP et, contrairement à de nombreux autres syndromes rhumatismaux, il n’existe pas de manifestations cliniques spécifiques, de sérologie ou d’autres résultats de laboratoire. En conséquence, le diagnostic peut être difficile.
Diagnostic En pratique quotidienne, le diagnostic de RMP repose principalement sur l’association suivante : apparition de symptômes matinaux de raideur et de douleurs au niveau de l’épaule et de la ceinture pelvienne chez une personne âgée de 50 ans ou plus, signes d’inflammation systémique avec augmentation de la vitesse de sédimentation des érythrocytes ( ESR) et/ou CRP, aucune autre maladie expliquant mieux la présentation clinique et finalement la réponse brutale aux GC. Dans certains critères de diagnostic, il existe d’autres exigences spécifiques, comme une durée des symptômes de 2 semaines ou des tests négatifs pour les facteurs rhumatoïdes ou les anticorps antinucléaires. |
Le diagnostic de RMP doit être envisagé cliniquement.
Le cas typique est celui d’une femme âgée présentant des douleurs et des raideurs bilatérales à l’épaule dès le matin. Des symptômes similaires surviennent souvent dans la ceinture pelvienne. Les symptômes s’atténuent généralement au cours de la journée. Des manifestations systémiques telles que fièvre, fatigue, perte d’appétit et perte de poids peuvent survenir chez environ un tiers des patients.
D’autres paramètres inflammatoires peuvent être élevés, tels que le nombre de globules blancs ou de plaquettes, et parfois les enzymes hépatiques ou la phosphatase alcaline peuvent être élevées, signe d’une inflammation systémique. À l’examen clinique, on note souvent une sensibilité à la palpation profonde des muscles autour des épaules et des cuisses. De plus, la mobilité des épaules est généralement limitée, sans atrophie ni faiblesse musculaire. Des signes occasionnels de synovite peuvent être observés au niveau des épaules, des articulations du poignet et des genoux. Enfin, en PMR, la plupart des patients répondront rapidement et de façon spectaculaire aux GC et, selon certains critères, cette réponse est nécessaire au diagnostic.
| Etudes d’imagerie |
En raison des symptômes non spécifiques ou des résultats de laboratoire de la PMR, il existe un besoin non satisfait d’autres modalités pour confirmer le diagnostic. Diverses modalités d’imagerie ont été utilisées en PMR, notamment la radiologie conventionnelle, la scintigraphie, la tomodensitométrie (TDM), l’imagerie par résonance magnétique (IRM), les ultrasons et la tomographie par émission de positons avec TDM (PET CT).
L’objectif des études d’imagerie en RMP n’est pas seulement de confirmer le diagnostic, mais aussi d’exclure des diagnostics différentiels ou des comorbidités et, dans certains cas, une coexistence avec une vascularite des gros vaisseaux.
L’échographie est utile dans la RMP en raison de la nature de l’atteinte des tissus mous extra-articulaires . Les signes les plus fréquents sont une inflammation et un épanchement de la bourse sous-acromiale-sous-deltoïdienne, une ténosynovite du biceps, une inflammation de l’articulation glénohumérale, ainsi qu’une synovite et une trochantérite de la hanche. L’échographie est également utile pour exclure d’autres diagnostics différentiels et pour détecter les vascularites des gros vaisseaux et les artérites crâniennes lorsqu’elles sont suspectées de coexister avec la PMR.
L’IRM a également été utilisée, même si son utilisation est encore limitée dans la recherche. Les résultats incluent un schéma caractéristique d’inflammation symétrique dans le grand trochanter, l’acétabulum et la tubérosité ischiatique, rapporté chez 64 % des patients atteints de PMR dans une étude. Dans une autre étude, tous les patients présentant une RMP d’apparition récente présentaient au moins un site d’inflammation myofasciale. Les avantages de l’IRM par rapport à l’échographie incluent le fait que l’IRM est plus spécifique avec moins de variations interobservateurs dans l’évaluation de la vascularite. Les inconvénients incluent la disponibilité et le coût.
La TEP CT a été utilisée en oncologie et dans la recherche sur les maladies inflammatoires. Chez les patients suspectés de RMP, l’utilisation de la TEP-TDM comme examen de routine n’est pas recommandée en raison de limitations telles que le coût et la disponibilité. En plus de son rôle dans la visualisation de l’inflammation dans les tissus articulaires et extra-articulaires, la TEP-CT est extrêmement utile pour confirmer une suspicion de vascularite des gros vaisseaux et pour différencier la RMP des autres affections, telles que les tumeurs malignes ou d’autres maladies rhumatismales. Son utilisation est justifiée chez les patients n’ayant pas répondu au traitement initial par GC. L’absence de réponse pourrait s’expliquer par la coexistence d’une vascularite des gros vaisseaux, d’autres maladies rhumatismales sous-jacentes ou d’une tumeur maligne.
> Autres études d’imagerie
La radiographie conventionnelle a déjà été utilisée dans ce contexte, en particulier chez les patients suspectés de RMP et de maladie articulaire périphérique. L’arthrite dans la RMP n’est généralement pas érosive, ce qui la distingue de l’arthrite destructrice typique de la PR ou d’autres maladies arthritiques telles que la chondrocalcinose. La scintigraphie n’est pas utilisée actuellement.
| Résultats de laboratoire |
Il n’existe aucun résultat sérologique ou autre résultat de laboratoire spécifique permettant de confirmer le diagnostic de RMP avec une certitude absolue.
Le résultat le plus fréquent et le plus important est l’élévation des paramètres inflammatoires tels que la VS ou la CRP. Cependant, une VS normale n’exclut pas le diagnostic de PMR. D’autres résultats incluent l’anémie normochrome normocytaire, la thrombocytose et la leucocytose.
| Diagnostic différentiel |
Les affections affectant les personnes de 50 ans ou plus et associées à des douleurs bilatérales à l’épaule doivent être incluses dans les diagnostics différentiels de la RMP. Le diagnostic différentiel doit inclure à la fois les maladies rhumatismales et non rhumatismales.
> Polyarthrite rhumatoïde
Parmi les affections rhumatismales les plus importantes dans le diagnostic différentiel de la RMP figure la PR séronégative. Cela est particulièrement vrai au début de la PR, qui peut comporter une phase prodromique d’arthrite bilatérale de l’articulation de l’épaule. De plus, la PR et la RMP peuvent présenter une arthrite au niveau des articulations du poignet, et si les patients ont un test négatif pour le facteur rhumatoïde et/ou le peptide citrulliné anticyclique (anti-CCP), il peut être difficile de faire la différence entre ces deux affections.
Cependant, la présence d’arthrites symétriques des petites articulations doit privilégier le diagnostic de PR. La PR et la PMR peuvent être traitées avec succès avec la prednisolone, ce qui limite l’utilité de ce médicament dans la différenciation. Les manifestations extra-articulaires typiques (ex. : nodules rhumatoïdes, vascularites cutanées, sérites, etc.) et les RF/anti-CCP positifs favorisent le diagnostic de PR plutôt que de PMR.
> Myosite
La polymyosite (PM ) est une autre maladie qui peut être diagnostiquée à tort comme une PMR et vice versa. Les deux conditions affectent les groupes musculaires proximaux des membres supérieurs et inférieurs. Cependant, la présence d’une faiblesse musculaire plutôt que d’une raideur et d’une douleur est une caractéristique différentielle importante de la MP. De plus, les PMR sont généralement associées à des taux sériques élevés d’enzymes musculaires, ce qui n’est pas une caractéristique de la PMR. D’autres caractéristiques favorisant la possibilité de PM sont la présence d’auto-anticorps spécifiques à la myosite et de manifestations extramusculaires. Des difficultés à avaler favoriseront le diagnostic de PM. La faiblesse musculaire pure n’est pas typique de la PMR.
> Syndromes douloureux
La différenciation entre la PMR et les syndromes douloureux tels que la fibromyalgie devrait être plus facile que d’autres diagnostics différentiels. La fibromyalgie apparaît généralement dans les groupes d’âge plus jeunes. De plus, il n’y a aucune élévation des paramètres de laboratoire indiquant un état inflammatoire. Il est important de faire la différence entre ces deux affections pour éviter une utilisation inutile de GC chez les patients atteints de fibromyalgie et de syndromes douloureux.
> Malignité
Les maladies malignes constituent un diagnostic différentiel important dans la RMP.
Les manifestations de PMR pourraient représenter un symptôme paranéoplasique. Les patients atteints de PMR qui ne répondent pas à une dose quotidienne de prednisolone de 15 à 25 mg ou qui présentent une récidive rapide des symptômes immédiatement après la diminution progressive des GC doivent alerter le médecin traitant de la possibilité d’une tumeur maligne sous-jacente.
La synovite symétrique séronégative rémittente avec œdème par piqûres est un syndrome clinique caractérisé par le développement d’une arthrite symétrique des petites articulations avec œdème des mains et des pieds, généralement chez les hommes âgés sans facteur rhumatoïde. Cette affection répond généralement bien à une courte cure de GC orale et devrait être l’un des diagnostics différentiels importants de la PMR. Un phénotype similaire peut être observé dans les syndromes paranéoplasiques.
> Autres
Les maladies dégénératives non inflammatoires, telles que l’arthrose cervicale et l’arthrose de la hanche, peuvent imiter la présentation d’une PMR avec des symptômes tels que des douleurs et des raideurs matinales. La confirmation radiologique de l’arthrose (OA) ou de l’arthrose ainsi que l’absence de paramètres inflammatoires actifs favoriseront le diagnostic d’arthrose et d’arthrose plutôt que celui de PMR. L’hypothyroïdie est une maladie courante chez les femmes souffrant de douleurs diffuses, de fatigue et d’un syndrome de type fibromyalgie.
| PMR en tant qu’événement lié à l’utilisation d’inhibiteurs de points de contrôle immunitaires dans le traitement du cancer |
Les inhibiteurs de points de contrôle immunitaires (ICI) sont de plus en plus utilisés dans le traitement du cancer pour améliorer la réponse immunitaire antitumorale. Le traitement par des anticorps monoclonaux bloquant la protéine CTLA-4, le récepteur (PD-1) ou son ligand PD-L1, a été associé au développement d’un certain nombre de maladies auto-immunes. La RMP est l’un des troubles rhumatismaux signalés comme événement connexe dans ce contexte.
En outre, plusieurs cas de « maladie de type PMR », avec certaines caractéristiques atypiques, ont été rapportés après un traitement par ICI. Une caractérisation minutieuse de tels cas pourrait nous guider dans la compréhension du rôle du système immunitaire adaptatif dans la physiopathologie de la RMP.
| Traitement |
> GC orale
La pierre angulaire du traitement de la PMR est la GC orale. Tous les symptômes de la PMR répondent généralement rapidement aux GC. La dose initiale quotidienne recommandée de prednisolone dans la PMR est de 12,5 à 25 mg selon la recommandation ACR/EULAR la plus récente. Une dose initiale de 20 mg est supérieure à 10 mg mais au prix d’un plus grand nombre d’événements indésirables. Le choix entre 12,5 et 25 mg doit tenir compte de l’activité inflammatoire, du risque de rechute et du risque de toxicité des GC dus à des comorbidités telles que le diabète ou les maladies cardiovasculaires.
La dose de prednisolone doit être progressivement réduite d’environ 2,5 mg par mois jusqu’à 10 mg par jour, après quoi la diminution plus lente se poursuit. Une mauvaise réponse au traitement doit conduire à reconsidérer d’éventuels diagnostics différentiels. Le traitement par GC doit être accompagné de mesures de soutien pour minimiser la toxicité à long terme telle que l’ostéoporose.
En général, le pronostic de la RMP est bon et la maladie guérit généralement en quelques années, période pendant laquelle une GC doit être prise pour contrôler la maladie et ses symptômes. Certains patients ont une évolution plus compliquée avec une inflammation résiduelle pendant le traitement et une réapparition des symptômes lorsqu’on tente de réduire la dose de GC. Dans une étude réalisée par Healey, seuls 30 % des patients ont pu arrêter le traitement par GC et rester asymptomatiques dans les 2 ans suivant le suivi, tandis que seulement 2 % ont pu arrêter complètement le traitement par GC dans les 6 mois.
> GC injectable
La méthylprednisolone intramusculaire (IMPM) a été comparée aux GC oraux dans le traitement de la PMR en termes d’efficacité et de sécurité. Dans une étude de Dasgupta et al., le taux de rémission après une phase en double aveugle de 12 semaines était similaire, mais la dose cumulée moyenne de GC dans le groupe méthylprednisolone intramusculaire après 96 semaines était de 56 % de celle du groupe méthylprednisolone intramusculaire. Groupe GC oral. Le groupe IM avait moins d’événements indésirables à long terme. MPim est probablement une alternative appropriée aux GC oraux chez les patients âgés prenant plusieurs médicaments, ainsi que chez les patients qui rencontrent un problème après le programme de réduction des GC oraux et chez les patients ayant des problèmes d’observance.
> Médicaments antirhumatismaux de fond et produits biologiques
En raison de la toxicité du traitement à long terme par GC, il existe un besoin évident de stratégies alternatives chez les patients atteints de PMR. Cependant, les médicaments antirhumatismaux qui ont eu un grand succès dans le traitement de la PR et de plusieurs autres troubles rhumatismaux n’ont pas été étudiés de manière approfondie dans la RMP.
Il existe certaines preuves du bénéfice du méthotrexate (MTX) chez les patients atteints de PMR. Dans un essai contrôlé randomisé (ECR) en double aveugle, un risque plus faible de rechute et une probabilité plus élevée d’arrêt du GC ont été démontrés chez les patients atteints d’une nouvelle PMR prenant du MTX en plus d’un régime GC régulier par rapport au groupe de comparaison. qui prenait GC + placebo. L’efficacité du MTX dans la RMP récurrente et de longue durée n’a pas été systématiquement évaluée.
Sur la base de ce type de preuves, le panel ACR/EULAR a recommandé sous condition d’envisager l’introduction précoce du MTX, en particulier pour les patients présentant un risque élevé de rechute et/ou un traitement prolongé, par exemple les patientes présentant une VS de base élevée (> 40 mm/h). , arthrite périphérique et/ou comorbidités qui peuvent être exacerbées par le traitement par GC.
Les données sur l’utilisation de l’azathioprine dans le traitement de la RMP sont très limitées. Malgré des preuves limitées, l’azathioprine a été utilisée chez certains patients atteints de RMP réfractaire. Les recommandations ACR/EULAR pour le traitement de la RMP n’incluent pas l’azathioprine. Une étude rétrospective de faible qualité a indiqué que l’hydroxychloroquine, un agent antipaludique utilisé pour d’autres affections, n’est pas efficace pour prévenir les rechutes de la RMP.
Étant donné que le tocilizumab, un anticorps monoclonal anti-récepteur de l’IL-6, s’est révélé efficace contre la GCA, il existe une justification pour l’étudier comme traitement pour la PMR. De nombreux rapports de cas et séries de cas suggèrent l’efficacité du tocilizumab intraveineux chez des patients individuels atteints de RMP. Une étude de cohorte rétrospective du traitement par tocilizumab ou MTX pour la RMP récidivante au Japon a indiqué un effet significatif du tocilizumab sur la préservation des GC, mais pas du MTX. Les ECR contrôlés par placebo sur les inhibiteurs du TNF, l’infliximab ou l’étanercept, n’ont montré aucun bénéfice significatif chez les patients atteints de RMP et ne sont donc pas recommandés pour le traitement de la RMP.
> Thérapies de soutien
L’utilisation à long terme du GC est un facteur important contribuant à plusieurs comorbidités chez les patients atteints de maladies rhumatismales, telles que la vascularite systémique, la PMR et la GCA. Il est recommandé que tous les patients atteints de RMP reçoivent d’autres traitements de soutien au début de leur maladie, tels que du calcium/vitamine D et des bisphosphonates, pour prévenir l’ostéoporose.
| Comorbidités |
Il existe peu d’informations sur les comorbidités chez les patients atteints de PMR provenant de grandes études épidémiologiques. Une revue systématique de la littérature a révélé certaines indications d’un risque accru de comorbidités chez les patients diagnostiqués avec une RMP. Ces comorbidités peuvent être regroupées en maladies vasculaires, cancer et autres maladies, ces dernières comprenant l’hypothyroïdie et la maladie diverticulaire.
La comorbidité la plus fréquemment rapportée après le diagnostic de PMR est la maladie vasculaire. Les affections vasculaires comprennent les accidents vasculaires cérébraux, l’infarctus du myocarde et les maladies vasculaires périphériques. Cela concorde avec un risque accru de maladies cardiovasculaires dans d’autres maladies inflammatoires chroniques telles que la PR.
Alors que certaines études faisaient état d’un risque accru de cancer, d’autres faisaient état d’un risque plus faible ou les résultats étaient équivoques. Concernant les autres comorbidités, il existe des données contradictoires sur une association avec l’hypothyroïdie. Certains rapports font état d’un risque accru de dépression, qui peut être associé à une douleur chronique ou à un traitement par GC.
Les données d’une récente étude de cohorte nationale britannique confirment le risque accru de maladie vasculaire après un diagnostic de RMP. En outre, il existait également un risque de maladies respiratoires, rénales et auto-immunes après le diagnostic de PMR. Au moins pour les deux derniers cas, l’explication pourrait être un biais de surveillance.
Les patients atteints de PMR présentent un taux élevé de comorbidités associées au traitement par GC, telles que l’ostéoporose, les fractures vertébrales, les infections, les cataractes et le glaucome. Cependant, dans une étude de cohorte menée à Olmstead, Minnesota, États-Unis, seules les cataractes étaient plus fréquentes chez les patients atteints de PMR suivis pendant une durée médiane de 5,8 ans par rapport aux comparateurs de même âge et sexe sans PMR.
Il est possible que l’absence de risque accru d’ostéoporose et de fractures reflète l’utilisation courante de la prophylaxie de l’ostéoporose dans ce groupe de patients avec un traitement planifié à long terme par GC et avec d’autres facteurs de risque d’ostéoporose. De telles tendances peuvent dépendre de l’accès aux soins dans différentes populations.
| Mortalité |
Compte tenu du fardeau élevé de comorbidité chez les patients atteints de RMP, il est important de déterminer si un diagnostic de RMP est associé à un risque accru de mortalité. Une revue systématique récente a révélé que les patients atteints de PMR présentaient un fardeau plus élevé de maladies comorbides que les témoins du même âge et du même sexe. Cependant, trois études antérieures ont rapporté une mortalité réduite chez les patients diagnostiqués avec une PMR.
Une explication possible à cela pourrait être un biais de surveillance. Les patients atteints de maladies chroniques (et en particulier de MPR où une évaluation, un suivi et un suivi réguliers sont recommandés) sont plus susceptibles de faire l’objet d’une surveillance active de leur état et de toute morbidité en développement conduisant à une prise en charge de la maladie à un stade précoce.
Une autre étude, connue pour être la plus grande étude ayant évalué l’effet d’un diagnostic de RMP sur l’espérance de vie, a montré qu’un diagnostic de RMP n’avait pas d’impact significatif sur l’espérance de vie. Par conséquent, un diagnostic de RMP ne semble pas augmenter le risque de décès prématuré.
Conclusion
|















