Nous présentons le cas d’un garçon de 14 ans atteint du syndrome de Down, qui souffre depuis six ans d’écoulements buccaux purulents importants, cliniquement évidents au réveil.
Plusieurs études ont démontré la présence d’un microbiote normal et avec Candida ssp . Pendant tout ce temps, la maladie était réfractaire aux traitements antimicrobiens et antifongiques conventionnels.
La muqueuse des lèvres et de la langue présente des lésions papillomateuses compatibles avec celles observées dans le syndrome de Cowden.
Le matériel de décharge a été étudié et le typage de Candida dubliniensis a été diagnostiqué, déterminant également la sensibilité au voriconazole avec la méthode de sensibilité antifongique.
L’écoulement s’est résolu grâce à un traitement à base de voriconazole.
L’objectif est de mettre en évidence la présence de matériel purulent d’origine fongique et l’importance du typage et de la sensibilité antifongique dans les cas résistants au fluconazole.
| Rapport de cas |
Le cas correspond à un garçon de 14 ans, trisomique, qui est référé à la clinique, avec une évolution de six ans, après avoir reçu différentes thérapies sans succès.
L’enfant souffrait d’un écoulement purulent, très visible le matin au réveil, sortant de la bouche par le coin, se déversant sur la peau du visage et sur l’oreiller (Fig. 1).
Les différentes études microbiologiques et mycologiques qui ont été réalisées au cours des six années de la maladie ont rapporté : un microbiote normal et la présence de Candida ssp . Suite à ce diagnostic, il a reçu de fortes doses d’antibiotiques et d’antifongiques pendant de longues périodes, en vain. On lui a également prescrit des bains de bouche de caractéristiques différentes, sans réponse.
Il est coeliaque et diabétique, sans autre altération à souligner, au-delà des caractéristiques de sa maladie sous-jacente.
Il a signalé une intervention chirurgicale buccale en milieu hospitalier pour retirer un kyste dentigère du palais en zone 22, à l’âge de 8 ans, sans complications postopératoires.
La caractéristique de la muqueuse labiale et linguale est frappante, elle présente une surface irrégulière avec un aspect papillomateux, laissant de profonds sillons entre les élévations, notamment sur la lèvre inférieure (Fig. 2).
Bien que, comme on le sait, la structure anatomique de la bouche dans ce syndrome présente des caractéristiques différenciées, la mère assure que cet aspect de la muqueuse coïncide avec l’apparition des écoulements purulents nocturnes. Elle associe également l’origine de la maladie au moment de son hospitalisation pour une chirurgie du kyste dentigère. Il existe une grande coïncidence clinique avec les lésions muqueuses observées dans le syndrome de Cowden.
Les biopsies des lèvres et de la langue sont indiquées, avec colorations HE et PAS, dont le rapport pathologique indique : Hyperplasie Epithéliale Inflammatoire associée à une Candidose Chronique.
La thyroïde, le tube digestif et la peau ont été étudiés en même temps pour exclure les lésions associées au syndrome de Cowden, et aucun signe de maladie n’a été trouvé.
Pour rechercher génétiquement si le patient souffrait du syndrome de Cowden, une étude moléculaire a été demandée par séquençage et micropuce du gène PTEN, extraction de l’ADN du sang périphérique, amplification PCR avec des amorces spécifiques pour chaque axone et purification. L’analyse des séquences des produits amplifiés de chaque exon a été réalisée avec l’analyseur génétique ABI PRIM 310. Le résultat indique que dans les exons 5,6,7,8, WILD TYPE, aucune altération n’a été observée.
Essayer d’identifier le foyer d’origine qui a produit l’écoulement, analyse clinique, scanner, IRM du crâne solide, du visage, du cou et du thorax, panoramique du cas.
Un profil immunologique est indiqué qui rapporte que même si certaines altérations immunologiques sont observées, elles ne sont pas toutes significatives. L’APECED (polyendocrinopathie auto-immune-candidose-dystrophie ectodermique) est exclue. Les niveaux d’hormone parathyroïdienne sont normaux. L’absence d’antécédents familiaux de candidose exclut les défauts de STAT 1.
Bien que les études microbiologiques antérieures et actuelles fournies par la mère de l’enfant aient été réalisées dans des laboratoires fiables, il a été décidé d’examiner l’enfant à son réveil et de récupérer à nouveau le matériel de l’écoulement.
L’échantillon obtenu était constitué d’une sécrétion purulente et son traitement a été effectué dans le Laboratoire de Diagnostic de la Chaire de Microbiologie et Parasitologie de la Faculté de Dentisterie de l’Université de Buenos Aires.
Des examens directs ont été réalisés sur l’échantillon par coloration de Gram et Giemsa. L’observation microscopique a révélé peu de bacilles à Gram négatif, des diplocoques à Gram positif et une bonne quantité de cellules de levure avec du pseudomycélium. Une réponse inflammatoire positive a été observée avec plus de 5 neutrophiles polymorphonucléaires par champ. 100 µl de l’échantillon ont été ensemencés par dispersion à la spatule Drigalski dans les milieux de culture suivants : Levine ; CLDE; BHI ; CHROMagar Candida® (CA) et incubé dans des conditions aérobies à 37ºC pendant 48 heures. De plus, l’échantillon a été semé sur un milieu laqué au sang dans des conditions anaérobies à 37 °C pendant 7 jours. Les colonies de cellules de levure ont été récupérées exclusivement à partir de tous les milieux de culture.
Dans le milieu CA, 105 UFC/ml de colonies vertes de Candida spp ont été isolées . Des méthodes phénotypiques et micromorphologiques ont été utilisées pour le typage. Des microcultures ont été réalisées sur Milk Agar de la colonie isolée et la formation de tube germinatif a été observée après 3 heures d’incubation à 37°C et la présence de pseudohyphes et de chlamyconidies après 48 heures à 28°C. Pour la différenciation entre les espèces de Candida albicans et Candida dubliniensis , la souche a été étalée sur Staib Agar (AS) à 30 ºC pendant 4 jours et sur Sabouraud glucose agar (ASG) à 45 ºC pendant 48 heures. Dans le milieu AS, la présence de pseudohyphes et de chlamyconidies a été observée et aucun développement n’a été obtenu dans l’ASG.
La méthode de diffusion sur disque selon le document CLSI M44-A2 a été utilisée pour évaluer la sensibilité antifongique aux médicaments fluconazole et voriconazole.
D’après les tests effectués, la souche étudiée a été phénotypée comme
Candida dubliniensis , sensible au voriconazole et résistante au fluconazole.
| Discussion |
En même temps que l’on recherchait l’origine de l’écoulement, la papillomatose buccale de Floride était exclue. Eversole décrit un cas de POF associé au syndrome de Down 1. L’anatomie pathologique était négative.
Le syndrome de Cowden est une maladie autosomique dominante caractérisée par de multiples tumeurs hamartomateuses d’origine ectodermique, mésodermique et endodermique. La maladie est due à des mutations du gène PTEN. L’étude génétique s’est également révélée négative. Torre et Cruces publient un cas de syndrome de Cowden et de syndrome de Down 2 .
La continuité et la résistance au traitement des écoulements purulents étaient surprenantes. Dans le cas d’un enfant trisomique, la première ligne de défense contre les bactéries et les virus, c’est-à-dire l’immunité innée, est clairement altérée qualitativement et quantitativement. Le nombre de cellules NK est souvent diminué et la phagocytose et la chimiotaxie des cellules polymorphonucléaires et des monocytes sont réduites, diminuant ainsi la capacité à tuer directement les agents pathogènes.
La deuxième ligne de défense, l’immunité adaptative médiée par les lymphocytes T, est également généralement altérée dans le syndrome de Down. Il existe une production réduite de cellules T DC4 et CD8 et un niveau de cytotoxicité inférieur requis pour lutter contre les agents pathogènes. Il y a une réduction des lymphocytes B et, bien que les taux d’immunoglobulines ne diminuent pas, la cytotoxicité dépendante des anticorps médiée par les cellules NK est diminuée 3,4,5.
Les enfants trisomiques présentent également une altération chromosomique qui affecte la structure anatomique de la bouche, entraînant une plus grande capacité d’ adhésion de Candida à la muqueuse affectée. Ces faits font des enfants atteints de ce syndrome de grands « chargeurs » de levures. les prédisposant à la candidose buccale et à d’autres infections 3 .
Bien que Candida albicans soit l’agent le plus fréquent des candidoses oropharyngées chez les patients immunodéprimés, sa prévalence a diminué ces dernières années, favorisant d’autres espèces telles que C. tropicalis, C. glabrata, C. krusei et, depuis 1996, la nouvelle espèce appelée C. .dubliniensis .
De manière générale, ces levures sont considérées comme le microbiote normal de la cavité buccale humaine. Une compétition s’établira donc entre C. albicans et C. dubliniensis 8
Cette utilisation prolongée d’antifongiques peut éliminer la compétition de C. dubliniensis avec d’autres champignons (principalement C. albicans ) et augmenter le risque de candidose oropharyngée 9 . En raison de sa grande similitude avec C. albicans , il est possible qu’il y ait une sous-notification des cas prévalents.
Dans certaines études, la candidose à C. dubliniensis a été associée à d’autres facteurs tels que des antécédents de consommation de drogues par voie intraveineuse, des maladies débilitantes sous-jacentes précédemment traitées (pendant une période ne dépassant pas 9 mois) avec du fluconazole , des patients séronégatifs pour le VIH, mais avec maladies débilitantes sous-jacentes telles que le diabète décompensé et l’utilisation de médicaments immunosuppresseurs 10 .
Une infection à l’hôpital par Candida dubliniensis a été décrite, ce qui ne permet pas d’exclure que, dans ce cas, elle ait pu débuter lorsque le patient a subi une intervention chirurgicale pour sa lésion du palais, comme le soutenait sa mère 12 .
Dans le cas présenté, les replis papillomateux provoqués par l’action de l’infection fongique chronique constituaient le réservoir idéal pour maintenir l’infection active pendant tant d’années. Figure 3
Le voriconazole, le médicament de choix dans ce cas, avec le posaconazole et le ravuconazole, sont des dérivés fluorés du triazole appelés « azoles de deuxième génération », comme le fluconazole et l’itraconazole.
Comme tous les azoles, les dérivés du triazole exercent leur activité par l’inhibition de certaines des nombreuses étapes conduisant à la synthèse de l’ergostérol et d’autres stérols. Ces composés sont des composants structurels fondamentaux de la membrane fongique et chacun d’eux a des fonctions spécifiques. Il est important de surveiller les effets secondaires possibles du médicament.
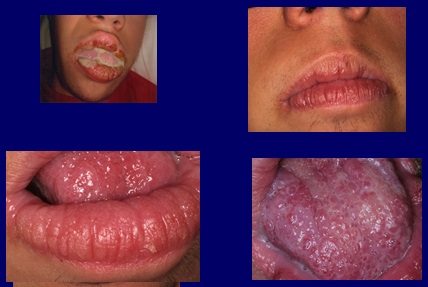
Le traitement a été débuté avec des comprimés de voriconazole à 200 mg, deux par jour pendant quatre mois, obtenant une inversion des symptômes, une disparition des écoulements et une amélioration de l’aspect clinique de la muqueuse (Fig. 4). Un contrôle clinique sérologique a été réalisé pour contrôler d’éventuels effets secondaires du médicament, qui heureusement ne se sont pas produits.
| Conclusion |
Candida dubliniensis est devenu un agent pathogène important, en particulier chez les patients immunodéprimés, avec des manifestations principalement dans la cavité buccale.
Le patient trisomique peut présenter des troubles immunologiques et des conditions anatomiques particulières dans la cavité buccale qui en font de grands « porteurs » de levures.
Candida dubliniensis présente certaines difficultés dans son identification, notamment lorsqu’il s’agit de se différencier de Candida albicans . Cette différenciation est importante en raison des différences de résistance aux traitements antifongiques. Il existe néanmoins des tests biochimiques et phénotypiques simples qui permettent de séparer ces levures.
Il est à noter que la présence de matériel purulent dans l’écoulement nous amène, en premier lieu, à indiquer une antibiothérapie, comme cela s’est produit dans le cas présenté, mais en l’absence de réponse à ladite thérapie, il faut penser à la nature fongique de l’infection et sélectionner l’antifongique indiqué 13,14, 15.16
Fig 1 Écoulement purulent important, cliniquement visible au réveil
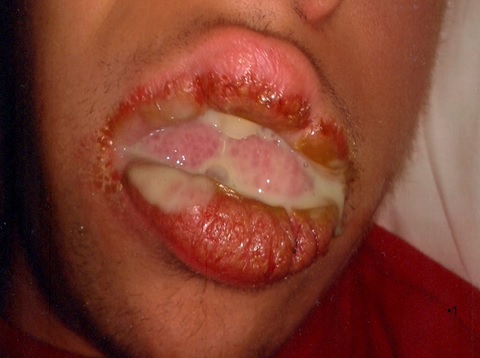
Fig 2 La muqueuse de la lèvre et de la langue présente des images papillomateuses compatibles avec le syndrome de Cowden.
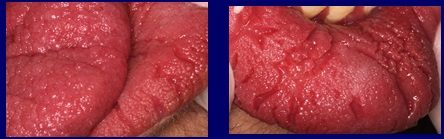
Fig3 Les plis et sillons papillomateux provoqués par l’action de l’infection fongique chronique constituent le réservoir idéal pour maintenir l’infection active.
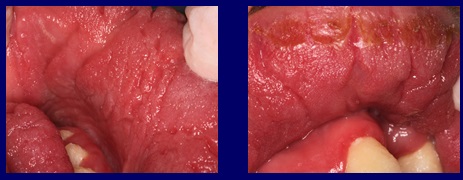
Fig4 Après un traitement au voriconazole, 200 milligrammes deux fois par jour pendant quatre mois, les écoulements purulents buccaux disparaissent et la texture de la muqueuse s’améliore.
Auteurs : Ceccotti EL1, Turcot L2, Molgatini S2Gliosca L2, Fedelli L2, Bruzzone R.3
1 Académie Nationale de Dentisterie
2 Chaire de Microbiologie et Parasitologie de la Faculté de Dentisterie de l’Université de Buenos Aires.
3 Ancien Prof, Chef de Clinique de Stomatologie. USAL.AOA















