| Einführung |
Es wird der Fall eines 14-jährigen Jungen mit Down-Syndrom vorgestellt, der seit sechs Jahren unter einem großen eitrigen Ausfluss aus dem Mund leidet, der sich klinisch beim Aufwachen manifestiert.
Mehrere Studien zeigten das Vorhandensein normaler Mikrobiota und mit Candida ssp . Während dieser gesamten Zeit war der Zustand gegenüber herkömmlichen antimikrobiellen und antimykotischen Behandlungen resistent.
Die Schleimhaut der Lippen und der Zunge weist papillomatöse Läsionen auf, die mit denen beim Cowden-Syndrom vergleichbar sind.
Das Ausflussmaterial wurde untersucht und durch Typisierung von Candida dubliniensis diagnostiziert, wobei auch die Empfindlichkeit gegenüber Voriconazol mit der antimykotischen Empfindlichkeitsmethode bestimmt wurde.
Der Ausfluss verschwand unter Behandlung mit Voriconazol.
Ziel ist es, das Vorhandensein von eitrigem Material pilzlichen Ursprungs hervorzuheben und die Bedeutung der antimykotischen Typisierung und Anfälligkeit bei Fluconazol-resistenten Fällen hervorzuheben.
| Fallbericht |
Der Fall betrifft einen 14-jährigen Jungen mit Down-Syndrom, der mit einer Entwicklung von sechs Jahren in die Klinik überwiesen wird, nachdem er verschiedene Therapien erfolglos erhalten hatte.
Das Kind litt unter einem eitrigen Ausfluss, der sich morgens beim Aufwachen deutlich bemerkbar machte und durch den Mundwinkel aus dem Mund austrat und sich auf die Gesichtshaut und das Kissen ergoss (Abb. 1).
Die verschiedenen mikrobiologischen und mykologischen Studien, die während der sechs Krankheitsjahre durchgeführt wurden, ergaben: normale Mikrobiota und das Vorhandensein von Candida ssp . Aufgrund dieser Diagnose erhielt er über lange Zeiträume vergeblich große Dosen Antibiotika und Antimykotika. Ihm wurden auch Mundspülungen mit unterschiedlichen Eigenschaften verschrieben, ohne dass eine Reaktion erfolgte.
Er leidet an Zöliakie und Diabetes und weist außer den Merkmalen seiner Grunderkrankung keine weiteren auffälligen Veränderungen auf.
Er berichtete über eine orale Operation in einem Krankenhaus zur Entfernung einer Zahnzyste am Gaumen in Zone 22 im Alter von 8 Jahren ohne postoperative Komplikationen.
Auffallend ist die Charakteristik der labialen und lingualen Schleimhaut, die eine unregelmäßige Oberfläche mit papillomatösem Aussehen aufweist und tiefe Furchen zwischen den Erhebungen, insbesondere an der Unterlippe, hinterlässt (Abb. 2).
Obwohl die anatomische Struktur des Mundes bei diesem Syndrom bekanntermaßen differenzierte Merkmale aufweist, versichert die Mutter, dass dieser Aspekt der Schleimhaut mit dem Auftreten des nächtlichen eitrigen Ausflusses zusammenfällt. Sie verbindet den Ursprung der Erkrankung auch mit dem Zeitpunkt ihres Krankenhausaufenthalts wegen einer Zahnzystenoperation. Es besteht eine große klinische Übereinstimmung mit den beim Cowden-Syndrom beobachteten Schleimhautläsionen.
Indiziert sind Lippen- und Zungenbiopsien mit HE- und PAS-Färbungen, deren pathologischer Befund Folgendes anzeigt: Entzündliche epitheliale Hyperplasie im Zusammenhang mit chronischer Candidiasis.
Gleichzeitig wurden die Schilddrüse, der Verdauungstrakt und die Haut untersucht, um Läsionen im Zusammenhang mit dem Cowden-Syndrom auszuschließen. Es wurden keine Hinweise auf eine Erkrankung gefunden.
Um genetisch zu untersuchen, ob der Patient am Cowden-Syndrom litt, wurde eine molekulare Studie mit Sequenzierung und Microarray des PTEN-Gens, Extraktion von DNA aus peripherem Blut, PCR-Amplifikation mit spezifischen Primern für jedes Axon und Reinigung angefordert. Die Analyse der Sequenzen der amplifizierten Produkte jedes Exons wurde mit dem genetischen Analysegerät ABI PRIM 310 durchgeführt. Das Ergebnis zeigt, dass in den Exons 5,6,7,8, WILD TYPE, keine Veränderungen beobachtet wurden.
Der Versuch, den ursprünglichen Herd zu identifizieren, der die Entladung hervorrief, führte zu einer klinischen Analyse, einer CT, einer MRT des soliden Schädels, des Gesichts, des Halses und des Brustkorbs und machte eine Panoramaaufnahme des Falles.
Es wird ein immunologisches Profil angezeigt, aus dem hervorgeht, dass zwar einige immunologische Veränderungen beobachtet werden, diese jedoch alle nicht signifikant sind. APECED (autoimmune Polyendokrinopathie-Candidiasis-ektodermale Dystrophie) ist ausgeschlossen. Der Parathormonspiegel ist normal. Das Fehlen einer familiären Vorgeschichte von Candidiasis schließt Defekte in STAT 1 aus.
Obwohl die früheren und aktuellen mikrobiologischen Untersuchungen der Mutter des Kindes in zuverlässigen Labors durchgeführt wurden, wurde beschlossen, das Kind beim Aufwachen zu untersuchen und erneut Material aus dem Ausfluss zu sammeln.
Die entnommene Probe bestand aus einem eitrigen Sekret und ihre Verarbeitung wurde im Diagnoselabor des Lehrstuhls für Mikrobiologie und Parasitologie der Fakultät für Zahnmedizin der Universität Buenos Aires durchgeführt.
An der Probe wurden direkte Untersuchungen mittels Gram- und Giemsa-Färbung durchgeführt. Die mikroskopische Beobachtung ergab wenige gramnegative Bazillen, grampositive Diplokokken und eine beträchtliche Menge Hefezellen mit Pseudomyzel. Bei mehr als 5 polymorphkernigen Neutrophilen pro Feld wurde eine positive Entzündungsreaktion beobachtet. 100 μl der Probe wurden durch Dispersion mit einem Drigalski-Spatel in den folgenden Kulturmedien ausgesät: Levine; CLDE; IHB; CHROMagar Candida® (CA) isoliert und unter aeroben Bedingungen bei 37 °C für 48 Stunden inkubiert. Zusätzlich wurde die Probe 7 Tage lang unter anaeroben Bedingungen bei 37 °C auf lackiertem Blutagar-Medium ausgesät. Kolonien von Hefezellen wurden ausschließlich aus allen Kulturmedien gewonnen.
Im CA-Medium wurden 105 KBE/ml grüne Kolonien von Candida spp. isoliert . Zur Typisierung kamen phänotypische und mikromorphologische Methoden zum Einsatz. Mikrokulturen wurden auf Milchagar der isolierten Kolonie durchgeführt und die Bildung von Keimschläuchen wurde nach 3 Stunden Inkubation bei 37 °C und das Vorhandensein von Pseudohyphen und Chlamykonidien nach 48 Stunden bei 28 °C beobachtet. Zur Unterscheidung zwischen den Arten Candida albicans und Candida dubliniensis wurde der Stamm 4 Tage lang bei 30 °C auf Staib-Agar (AS) und 48 Stunden lang bei 45 °C auf Sabouraud-Glucose-Agar (ASG) ausplattiert. Im AS-Medium wurde das Vorhandensein von Pseudohyphen und Chlamykonidien beobachtet und im ASG wurde keine Entwicklung beobachtet.
Die Scheibendiffusionsmethode gemäß CLSI-Dokument M44-A2 wurde verwendet, um die antimykotische Empfindlichkeit gegenüber den Arzneimitteln Fluconazol und Voriconazol zu ermitteln.
Den durchgeführten Tests zufolge wurde der untersuchte Stamm als phänotypisiert
Candida dubliniensis , der gegenüber Voriconazol empfindlich und gegenüber Fluconazol resistent war.
| Diskussion |
Gleichzeitig mit der Suche nach dem Ursprung des Ausflusses wurde die Florida Oral Papillomatose ausgeschlossen. Eversole beschreibt einen Fall von POF im Zusammenhang mit Down-Syndrom 1. Die pathologische Anatomie war negativ.
Das Cowden-Syndrom ist eine autosomal-dominant vererbte Erkrankung, die durch mehrere hamartomatöse Tumoren ektodermalen, mesodermalen und endodermalen Ursprungs gekennzeichnet ist. Die Störung ist auf Mutationen des PTEN-Gens zurückzuführen. Auch die genetische Untersuchung verlief negativ. Torre und Cruces veröffentlichen einen Fall von Cowden-Syndrom und Down-Syndrom 2.
Überraschend war die Kontinuität und Therapieresistenz des eitrigen Ausflusses. Bei einem Kind mit Down-Syndrom ist die erste Verteidigungslinie gegen Bakterien und Viren, also die angeborene Immunität, deutlich qualitativ und quantitativ verändert. Die Anzahl der NK-Zellen ist häufig verringert und die Phagozytose und Chemotaxis polymorphkerniger Zellen und Monozyten sind verringert, wodurch die Fähigkeit zur direkten Abtötung von Krankheitserregern verringert wird.
Auch die zweite Verteidigungslinie, die T-Zell-vermittelte adaptive Immunität, ist beim Down-Syndrom meist verändert. Es kommt zu einer verminderten Produktion in DC4- und CD8-T-Zellen und zu einer geringeren Zytotoxizität, die zur Bekämpfung von Krankheitserregern erforderlich ist. Es kommt zu einer Verringerung der B-Lymphozyten, und obwohl die Immunglobulinspiegel möglicherweise nicht verringert werden, ist die durch NK-Zellen vermittelte antikörperabhängige Zytotoxizität verringert 3,4,5.
Kinder mit Down-Syndrom weisen außerdem eine chromosomale Veränderung auf, die sich auf die anatomische Struktur des Mundes auswirkt und dazu führt, dass Candida besser an der betroffenen Schleimhaut haften kann. Diese Tatsachen machen Kinder mit diesem Syndrom zu großen „Hefe-Trägern“. Dadurch werden sie anfälliger für orale Candidiasis und andere Infektionen 3 .
Obwohl Candida albicans der häufigste Erreger der oropharyngealen Candidiasis bei immunsupprimierten Patienten ist, ist seine Prävalenz in den letzten Jahren zurückgegangen und begünstigt andere Arten wie C. Tropicalis, C. Glabrata, C. Krusei und seit 1996 die neue Art C . .dubliniensis .
Im Allgemeinen gelten diese Hefen als normale Mikrobiota der menschlichen Mundhöhle. Daher entsteht eine Konkurrenz zwischen C. albicans und C. dubliniensis 8
Dieser längere Einsatz von Antimykotika kann die Konkurrenz von C. dubliniensis mit anderen Pilzen (hauptsächlich C. albicans ) ausschalten und das Risiko einer oropharyngealen Candidiasis erhöhen 9 . Aufgrund der großen Ähnlichkeit mit C. albicans ist es möglich, dass häufige Fälle nicht ausreichend gemeldet werden.
In einigen Studien wurde C. dubliniensis- Candidiasis mit anderen Faktoren in Verbindung gebracht, wie z. B. intravenösem Drogenkonsum in der Vorgeschichte, schwächenden Grunderkrankungen, die zuvor (über einen Zeitraum von nicht mehr als 9 Monaten) mit Fluconazol behandelt wurden , HIV-negativen Patienten, aber mit zugrunde liegende schwächende Krankheiten wie dekompensierter Diabetes und die Einnahme von Immunsuppressiva 10 .
Es wurde eine Krankenhausinfektion durch Candida dubliniensis beschrieben, was uns nicht ausschließen lässt, dass sie in diesem Fall, wie seine Mutter behauptete, zu dem Zeitpunkt begonnen haben könnte, als sich der Patient einer Operation wegen seiner Gaumenläsion unterzog 12 .
Im vorliegenden Fall stellten die papillomatösen Falten, die durch die Einwirkung der chronischen Pilzinfektion entstanden waren, das ideale Reservoir dar, um die Infektion über so viele Jahre hinweg aktiv zu halten. Abb. 3
Voriconazol, das Medikament der Wahl in diesem Fall, ist neben Posaconazol und Ravuconazol fluorierte Triazolderivate, die wie Fluconazol und Itraconazol als „Azole der zweiten Generation“ bezeichnet werden.
Wie alle Azole üben Triazolderivate ihre Aktivität durch die Hemmung einiger der zahlreichen Schritte aus, die zur Synthese von Ergosterol und anderen Sterolen führen. Diese Verbindungen sind grundlegende Strukturbestandteile der Pilzmembran und jede von ihnen hat spezifische Funktionen. Es ist wichtig, mögliche Nebenwirkungen des Arzneimittels zu überwachen.
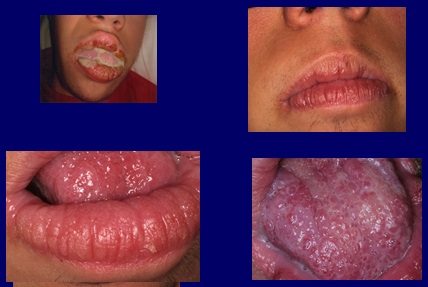
Die Behandlung wurde mit 200-mg-Voriconazol-Tabletten begonnen, zwei pro Tag über einen Zeitraum von vier Monaten, was zu einer Umkehrung der Symptome führte, den Ausfluss verschwand und das klinische Erscheinungsbild der Schleimhaut verbesserte (Abb. 4). Zur Kontrolle möglicher Nebenwirkungen des Arzneimittels wurde eine serologische klinische Kontrolle durchgeführt, die glücklicherweise nicht auftrat.
| Abschluss |
Candida dubliniensis hat sich als wichtiger Krankheitserreger herausgestellt, insbesondere bei immungeschwächten Patienten mit Manifestationen hauptsächlich in der Mundhöhle.
Patienten mit Down-Syndrom können immunologische Störungen und besondere anatomische Bedingungen in der Mundhöhle aufweisen, die sie zu hervorragenden „Überträgern“ von Hefepilzen machen.
Candida dubliniensis bereitet gewisse Schwierigkeiten bei der Identifizierung, insbesondere wenn es darum geht, von Candida albicans unterschieden zu werden . Diese Differenzierung ist aufgrund der unterschiedlichen Resistenz gegenüber einer Antimykotika-Behandlung wichtig. Dennoch gibt es einfache biochemische und phänotypische Tests, die eine Trennung dieser Hefen ermöglichen.
Es ist bemerkenswert, dass das Vorhandensein von eitrigem Material im Ausfluss uns zunächst dazu veranlasst, eine Antibiotikatherapie zu empfehlen, wie dies im vorliegenden Fall der Fall war. Da jedoch keine Reaktion auf diese Therapie erfolgt, müssen wir über die Pilznatur nachdenken die Infektion und wählen Sie das angegebene Antimykotikum aus 13,14, 15.16
Abb. 1 Großer eitriger Ausfluss, klinisch sichtbar beim Aufwachen
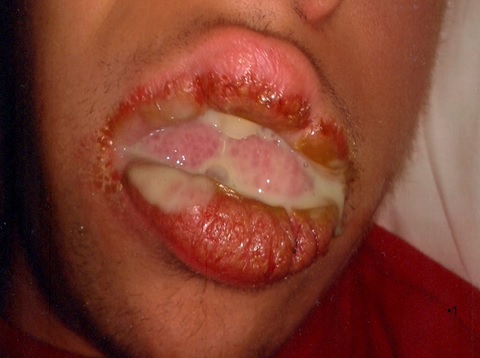
Abb. 2 Die Schleimhaut von Lippe und Zunge zeigt papillomatöse Bilder, die mit dem Cowden-Syndrom vereinbar sind.
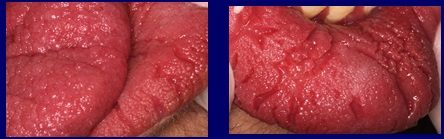
Abb.3 Die papillomatösen Falten und Furchen, die durch die Einwirkung der chronischen Pilzinfektion entstehen, bilden das ideale Reservoir, um die Infektion aktiv zu halten.
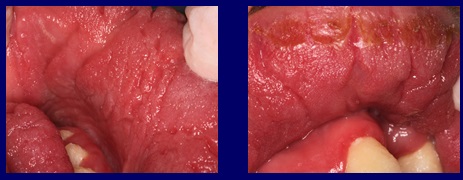
Abb. 4 Nach einer viermonatigen Behandlung mit Voriconazol, 200 Milligramm zweimal täglich, verschwindet der orale eitrige Ausfluss und die Textur der Schleimhaut verbessert sich.
Autoren: Ceccotti EL1, Turcot L2, Molgatini S2Gliosca L2, Fedelli L2, Bruzzone R.3
1 Nationale Akademie für Zahnmedizin
2 Lehrstuhl für Mikrobiologie und Parasitologie der Fakultät für Zahnmedizin der Universität Buenos Aires.
3 Ehemaliger Professor, Leiter der Klinik für Stomatologie. USAL.AOA















