Viene presentato il caso di un ragazzo di 14 anni con sindrome di Down, che da sei anni soffre di un’ampia secrezione orale purulenta, clinicamente evidente al risveglio.
Diversi studi hanno dimostrato la presenza di microbiota normale e con Candida ssp . Durante tutto questo tempo, la condizione era refrattaria ai trattamenti antimicrobici e antifungini convenzionali.
La mucosa delle labbra e della lingua presenta lesioni papillomatose compatibili con quelle osservate nella sindrome di Cowden.
È stato studiato il materiale di scarico e tramite tipizzazione è stata diagnosticata Candida dubliniensis, determinando anche la sensibilità al voriconazolo con il metodo della sensibilità antifungina.
La dimissione si è risolta con terapia a base di voriconazolo.
Lo scopo è quello di evidenziare la presenza di materiale purulento di origine fungina e l’importanza della tipizzazione antifungina e della suscettibilità nei casi resistenti al fluconazolo.
| Caso clinico |
Il caso corrisponde a un ragazzo di 14 anni, affetto da sindrome di Down, che viene ricoverato in clinica, con un’evoluzione di sei anni, dopo aver ricevuto diverse terapie senza successo.
Il bambino soffriva di secrezioni purulente, molto evidenti la mattina al risveglio, che uscivano dalla bocca attraverso l’angolo e si riversavano sulla pelle del viso e sul cuscino (Fig. 1).
I diversi studi microbiologici e micologici effettuati durante i sei anni di malattia hanno riportato: microbiota normale e presenza di Candida ssp . Con quella diagnosi, ha ricevuto grandi dosi di antibiotici e antimicotici per lunghi periodi senza alcun risultato. Gli sono stati prescritti anche collutori di diverse caratteristiche senza alcuna risposta.
È celiaco e diabetico, senza altre alterazioni da evidenziare, oltre alle caratteristiche della malattia di base.
Ha riferito di un intervento chirurgico orale in ospedale per rimuovere una cisti dentigera sul palato nella zona 22, all’età di 8 anni, senza complicazioni postoperatorie.
Colpisce la caratteristica della mucosa labiale e linguale, che presenta una superficie irregolare dall’aspetto papillomatoso, lasciando profondi solchi tra i rilievi, soprattutto sul labbro inferiore (Fig. 2).
Sebbene, come è noto, la struttura anatomica della bocca in questa sindrome presenti caratteristiche differenziate, la madre assicura che questo aspetto della mucosa coincide con la comparsa della secrezione purulenta notturna. Inoltre associa l’origine della condizione al momento del suo ricovero in ospedale per un intervento chirurgico alla ciste dentigera. Esiste una grande coincidenza clinica con le lesioni della mucosa osservate nella sindrome di Cowden.
Sono indicate biopsie del labbro e della lingua, con colorazioni HE e PAS, il cui referto patologico indica: Iperplasia epiteliale infiammatoria associata a candidosi cronica.
Contemporaneamente furono studiati la tiroide, il tratto digestivo e la pelle per escludere lesioni associate alla sindrome di Cowden e non fu trovata alcuna evidenza di malattia.
Per indagare geneticamente se il paziente soffrisse della Sindrome di Cowden, è stato richiesto uno studio molecolare mediante sequenziamento e microarray del gene PTEN, estrazione di DNA da sangue periferico, amplificazione PCR con primer specifici per ciascun assone e purificazione. L’analisi delle sequenze dei prodotti amplificati di ciascun esone è stata effettuata con l’analizzatore genetico ABI PRIM 310. Il risultato riporta che negli esoni 5,6,7,8, WILD TYPE, non sono state osservate alterazioni.
Cercando di identificare il focolaio originale che ha prodotto la dimissione, analisi clinica, TC, RM del cranio solido, viso, collo e torace, panoramica del caso.
Viene indicato un profilo immunologico che riporta che, sebbene si osservino alcune alterazioni immunologiche, tutte non sono significative. L’APECED (poliendocrinopatia autoimmune-candidosi-distrofia ectodermica) è esclusa. I livelli dell’ormone paratiroideo sono normali. L’assenza di una storia familiare di candidosi esclude difetti nella STAT 1.
Sebbene gli studi microbiologici precedenti e attuali forniti dalla madre del bambino siano stati effettuati in laboratori affidabili, si è deciso di esaminare il bambino al risveglio e di raccogliere nuovamente il materiale dalle dimissioni.
Il campione ottenuto era costituito da una secrezione purulenta e il suo trattamento è stato effettuato nel Laboratorio Diagnostico della Cattedra di Microbiologia e Parassitologia della Facoltà di Odontoiatria dell’Università di Buenos Aires.
Gli esami diretti sono stati eseguiti utilizzando il campione utilizzando la colorazione di Gram e Giemsa. L’osservazione microscopica ha rivelato pochi bacilli gram-negativi, diplococchi gram-positivi e una discreta quantità di cellule di lievito con pseudomicelio. È stata osservata una risposta infiammatoria positiva con più di 5 neutrofili polimorfonucleati per campo. 100 μl del campione sono stati seminati mediante dispersione con una spatola Drigalski nei seguenti terreni di coltura: Levine; CLDE; IHB; CHROMagar Candida® (CA) e incubato in condizioni aerobiche a 37°C per 48 ore. Inoltre, il campione è stato seminato su terreno Lacquered Blood Agar in condizioni anaerobiche a 37°C per 7 giorni. Le colonie di cellule di lievito sono state recuperate esclusivamente da tutti i terreni di coltura.
Nel terreno CA sono state isolate 105 CFU/ml di colonie verdi di Candida spp . Per la tipizzazione sono stati utilizzati metodi fenotipici e micromorfologici. Sono state effettuate microcolture su Milk Agar della colonia isolata ed è stata osservata la formazione del tubo germinale dopo 3 ore di incubazione a 37°C e la presenza di pseudoife e clamiconidi dopo 48 ore a 28°C. Per la differenziazione tra le specie di Candida albicans e Candida dubliniensis , il ceppo è stato piastrato su Staib Agar (AS) a 30°C per 4 giorni e su Sabouraud glucosio agar (ASG) a 45°C per 48 ore. Nel terreno AS è stata osservata la presenza di pseudoife e clamiconidi e non è stato ottenuto alcuno sviluppo nell’ASG.
Per valutare la sensibilità antifungina ai farmaci fluconazolo e voriconazolo è stato utilizzato il metodo di diffusione su disco secondo il documento CLSI M44-A2.
Secondo i test effettuati, il ceppo studiato è stato fenotipizzato come
Candida dubliniensis , che era sensibile al voriconazolo e resistente al fluconazolo.
| Discussione |
Contemporaneamente alla ricerca dell’origine della secrezione, è stata esclusa la papillomatosi orale della Florida. Eversole descrive un caso di POF associato alla sindrome di Down 1. L’anatomia patologica era negativa.
La sindrome di Cowden è una malattia autosomica dominante caratterizzata da tumori multipli amartomatosi di origine ectodermica, mesodermica ed endodermica. Il disturbo è dovuto a mutazioni del gene PTEN. Negativo anche lo studio genetico. Torre e Cruces pubblicano un caso di Sindrome di Cowden e Sindrome di Down 2 .
Sorprendente è stata la continuità e la resistenza alla terapia delle secrezioni purulente. Nel caso di un bambino con sindrome di Down, la prima linea di difesa contro batteri e virus, cioè l’immunità innata, è chiaramente qualitativamente e quantitativamente alterata. Il numero di cellule NK è spesso ridotto e la fagocitosi e la chemiotassi delle cellule polimorfonucleate e dei monociti sono ridotte, diminuendo così la capacità di uccidere direttamente i patogeni.
Anche la seconda linea di difesa, l’immunità adattativa mediata dalle cellule T, è solitamente alterata nella sindrome di Down. Vi è una produzione ridotta nelle cellule T DC4 e CD8 e un livello inferiore di citotossicità richiesto per affrontare gli agenti patogeni. Si verifica una riduzione dei linfociti B e, sebbene i livelli di immunoglobuline non possano diminuire, la citotossicità anticorpo-dipendente mediata dalle cellule NK viene ridotta3,4,5.
I bambini con Sindrome di Down presentano inoltre un’alterazione cromosomica che colpisce la struttura anatomica della bocca, comportando una maggiore capacità della Candida di aderire alla mucosa colpita. Questi fatti rendono i bambini affetti da questa sindrome degli ottimi “caricatori” di lieviti. predisporli alla candidosi orale e ad altre infezioni 3 .
Sebbene la Candida albicans sia stata l’agente più frequente nella candidosi orofaringea nei pazienti immunodepressi, negli ultimi anni la sua prevalenza è diminuita, favorendo altre specie come C. tropicalis, C. glabrata, C. krusei e, dal 1996, la nuova specie denominata C. .dubliniensis .
In generale, questi lieviti sono considerati il normale microbiota della cavità orale umana. Pertanto, verrà stabilita la competizione tra C. albicans e C. dubliniensis 8
Questo uso prolungato di antifungini può eliminare la competizione di C. dubliniensis con altri funghi (principalmente C. albicans ) e aumentare il rischio di candidosi orofaringea 9 . A causa della sua grande somiglianza con C. albicans , è possibile che i casi prevalenti siano sottostimati.
In alcuni studi, la candidosi da C. dubliniensis è stata associata ad altri fattori come storia di uso di farmaci per via endovenosa, malattie debilitanti sottostanti precedentemente trattate (per un periodo non superiore a 9 mesi) con fluconazolo , pazienti HIV negativi, ma con malattie debilitanti sottostanti come il diabete scompensato e l’uso di farmaci immunosoppressori 10 .
È stata descritta un’infezione intraospedaliera da Candida dubliniensis , il che non consente di escludere che in questo caso possa essere iniziata quando il paziente è stato sottoposto ad un intervento chirurgico per lesione del palato, come sosteneva la madre 12 .
Nel caso presentato, le pieghe papillomatose provocate dall’azione dell’infezione fungina cronica costituivano il serbatoio ideale per mantenere attiva l’infezione per tanti anni. Figura 3
Il voriconazolo, il farmaco d’elezione in questo caso, insieme a posaconazolo e ravuconazolo, sono derivati fluorurati del triazolo chiamati “azoli di seconda generazione”, come il fluconazolo e l’itraconazolo.
Come tutti gli azoli, i derivati triazolici esplicano la loro attività attraverso l’inibizione di alcuni dei numerosi passaggi che portano alla sintesi dell’ergosterolo e di altri steroli. Questi composti sono componenti strutturali fondamentali della membrana fungina e ciascuno di essi ha funzioni specifiche. È importante monitorare i possibili effetti collaterali del farmaco.
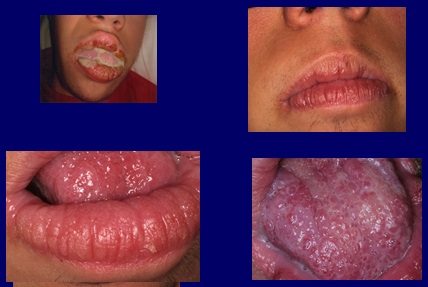
Il trattamento è stato iniziato con voriconazolo 200 mg compresse, due al giorno per quattro mesi, ottenendo una regressione dei sintomi, la scomparsa delle secrezioni ed un miglioramento dell’aspetto clinico della mucosa (Fig. 4). È stato effettuato un controllo clinico sierologico per controllare eventuali effetti collaterali del farmaco, che fortunatamente non si sono verificati.
| Conclusione |
La Candida dubliniensis è emersa come un importante patogeno, soprattutto nei pazienti immunocompromessi con manifestazioni principalmente nella cavità orale.
Il paziente con Sindrome di Down può presentare disturbi immunologici e particolari condizioni anatomiche del cavo orale che lo rendono un ottimo “portatore” di lievito.
La Candida dubliniensis presenta alcune difficoltà nella sua identificazione, in particolare quando si tratta di differenziarla dalla Candida albicans . Questa differenziazione è importante a causa delle differenze nella resistenza al trattamento antifungino. Nonostante ciò, esistono semplici test biochimici e fenotipici che consentono di separare questi lieviti.
È interessante notare che la presenza di materiale purulento nelle secrezioni ci porta, in prima battuta, ad indicare una terapia antibiotica, come avvenuto nel caso presentato, ma in assenza di risposta a tale terapia, bisogna pensare alla natura micotica della secrezione l’infezione e selezionare l’antifungino indicato 13,14, 15.16
Fig 1 Grossa secrezione purulenta, clinicamente visibile al risveglio
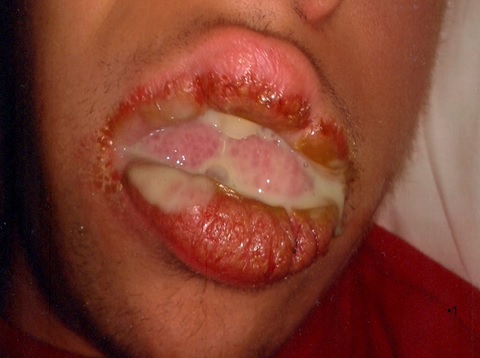
Fig 2 La mucosa del labbro e della lingua presenta immagini papillomatose compatibili con la sindrome di Cowden.
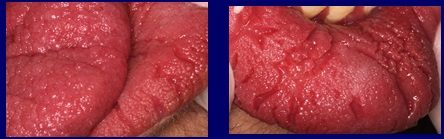
Fig3 Le pieghe ed i solchi papillomatosi causati dall’azione dell’infezione fungina cronica costituiscono il serbatoio ideale per mantenere attiva l’infezione.
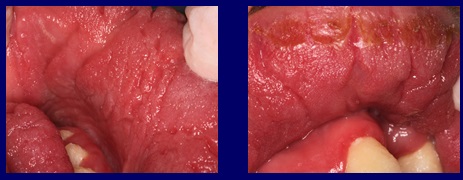
Fig4 Dopo il trattamento con voriconazolo, 200 mg due volte al giorno per quattro mesi, scompare lo scolo purulento orale e la consistenza della mucosa migliora.
Autori: Ceccotti EL1, Turcot L2, Molgatini S2Gliosca L2, Fedelli L2, Bruzzone R.3
1 Accademia Nazionale di Odontoiatria
2 Cattedra di Microbiologia e Parassitologia della Facoltà di Odontoiatria dell’Università di Buenos Aires.
3 Ex professore, primario della clinica di stomatologia. USAL.AOA















