Cas clinique Un homme de 35 ans ayant des antécédents de maladie inflammatoire de l’intestin se présente aux urgences avec 2 jours de douleurs abdominales. La douleur n’est pas localisée, son intensité varie et n’irradie pas. Il signale une aggravation des nausées, des vomissements et de l’anorexie pendant cette période. Sa dernière selle remonte à 2 jours et il nie le méléna ou l’hématochezia. Ses antécédents chirurgicaux sont significatifs : une appendicectomie 5 ans plus tôt et une cholécystectomie 2 ans plus tôt. À l’examen, il est pâle et diaphorétique, et son abdomen est diffus et sensible. Ses signes vitaux sont : fréquence cardiaque 110, tension artérielle 92/60 et température 99,6°F. Même si vous craignez une occlusion de l’intestin grêle, les anomalies des signes vitaux du patient laissent suspecter une occlusion compliquée. |
Quelles sont vos prochaines étapes de soins ?
Les viscères creux perforés sont la complication redoutée de l’occlusion intestinale, entraînant souvent un sepsis et une péritonite, avec un taux de mortalité atteignant 30 à 50 %. En particulier, les obstructions en boucle fermée et les obstructions étranglées présentent un risque de perforation plus élevé.
Il existe de nombreuses autres causes de perforation intestinale, notamment les traumatismes, l’ingestion de corps étrangers, la diverticulite, les maladies inflammatoires de l’intestin, la colite stéroïdienne, l’ulcère gastroduodénal, l’ischémie et le cancer. Même si certaines causes sont plus insidieuses que d’autres, leurs pronostics sont similaires.
Par la suite, une reconnaissance précoce des patients à haut risque de perforation, un diagnostic immédiat, une prise en charge appropriée et une consultation chirurgicale urgente sont essentiels pour prévenir la mortalité chez les patients présentant des viscères creux perforés.
Facteurs de risque, signes et symptômes
Les patients ayant des antécédents de chirurgie abdominale, de radiothérapie, de maladie inflammatoire de l’intestin ou de cancer du côlon courent un risque accru d’occlusions et de perforations intestinales. Plus précisément, le développement d’adhérences, les modifications anatomiques résultant d’interventions chirurgicales antérieures, les tumeurs et tout processus inflammatoire chronique rendent les patients vulnérables au développement d’une occlusion intestinale compliquée.
De plus, les perforations intestinales se présentent de la même manière que les obstructions intestinales et les patients souffrent souvent de nausées, de vomissements, de douleurs abdominales et de ballonnements.
À l’examen physique , les patients peuvent présenter une sensibilité abdominale localisée ou diffuse, souvent accompagnée de gardes, et peuvent avoir des bruits intestinaux hyperactifs (en cas d’occlusion intestinale à un stade précoce) ou une diminution ou une absence de bruits intestinaux (en cas d’occlusion intestinale à un stade avancé). Bien que classiquement associée à une ischémie intestinale, une douleur disproportionnée peut être retrouvée à l’examen chez les patients présentant une perforation.
De plus, les signes de septicémie et de péritonite , notamment fièvre et leucocytose, ne sont pas rares chez les patients présentant des viscères perforés. Cependant, l’instabilité hémodynamique, telle que l’hypotension et la tachycardie, peut être absente et les patients peuvent sembler faussement stables en cas de présentations tardives.
Etude d’urgence
Les études de laboratoire sur les sérums ne sont généralement pas spécifiques aux patients présentant une perforation intestinale, mais peuvent constituer un guide utile pour la réanimation et l’optimisation de l’intervention chirurgicale. Les patients doivent être considérés comme instables et nécessitant une réanimation rapide et probablement une intervention chirurgicale d’urgence s’ils présentent une instabilité hémodynamique, un pH <7,2, un excès de base <-8 ou des signes de coagulopathie.
Chez un patient avec une forte suspicion de viscère perforé, la première image obtenue est une radiographie abdominale debout . Les radiographies abdominales sont de bons outils de dépistage en raison de leur facilité d’accès et de leur faible coût. Bien que les radiographies abdominales puissent détecter rapidement une perforation, elles n’ont qu’une sensibilité de 66 à 85 % et peuvent être non spécifiques.
La découverte la plus courante de viscères perforés à la radiographie est l’air libre sous le diaphragme , mais cela peut être absent s’il y a un minimum d’air libre ou si le patient est allongé (en raison de son état) plutôt que debout (Figure 1).
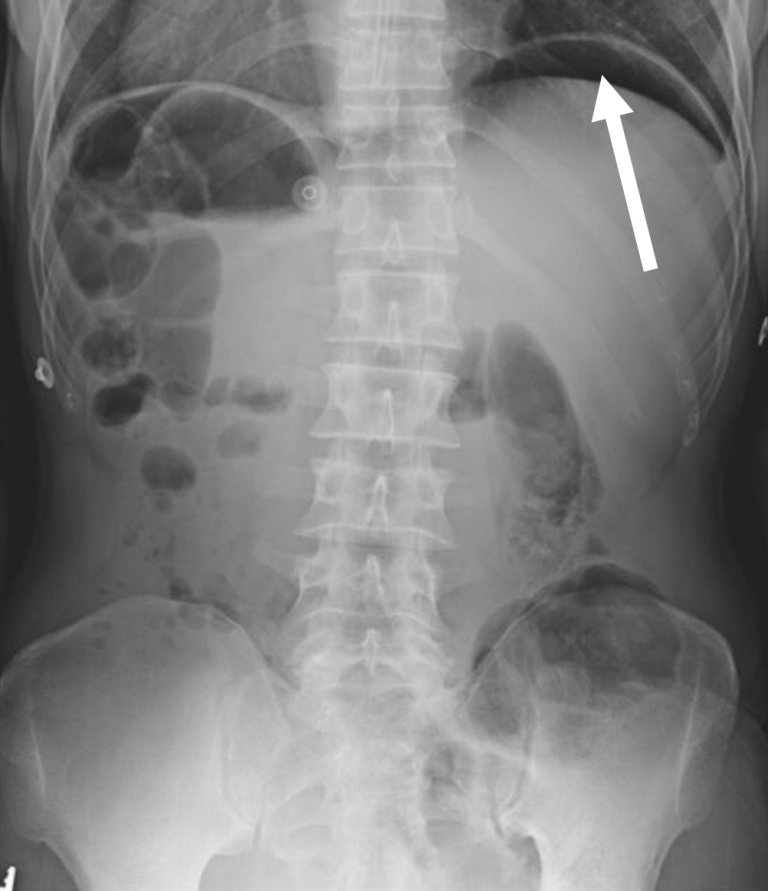
Figure 1 . Une radiographie abdominale de face, debout, montre de l’air libre sous l’hémidiaphragme gauche, évoquant une lésion du viscère creux (flèche blanche).
La sensibilité et la spécificité de la tomodensitométrie (TDM) de l’abdomen et du bassin pour une occlusion intestinale approchent 100 %, mais sa capacité à détecter des complications telles que des perforations est plus faible (Figure 2). Bien que considérée comme la référence, la tomodensitométrie n’identifie le site de perforation que dans 82 à 90 % des cas.
Par la suite, des réévaluations fréquentes, des examens abdominaux en série et la prise en compte de l’état clinique général du patient sont essentiels chez les patients présentant un processus obstructif ; Une nouvelle instabilité hémodynamique ou une péritonite peut évoquer l’apparition ou l’aggravation d’une perforation intestinale malgré l’absence de preuves radiographiques au scanner.
De plus, jusqu’à 24 % des occlusions de l’intestin grêle nécessitent une intervention chirurgicale, soit en raison du développement de complications ou de l’échec du traitement médical, et l’imagerie tomodensitométrique aux urgences peut faciliter la planification chirurgicale.
Un scanner avec contraste intraveineux est préféré au contraste oral ou rectal, en particulier parce que les patients souffrant de nausées et de vomissements ne peuvent souvent pas tolérer le contraste oral. Dans le cadre d’obstructions ou de perforations intestinales, la littérature est rare comparant les différentes modalités de contraste (IV, orale ou rectale). Cependant, une méta-analyse n’a montré aucune différence dans l’identification des perforations lors de la comparaison d’un produit de contraste intraveineux et oral, bien que cette étude ait été réalisée chez des patients présentant une perforation secondaire à un traumatisme abdominal fermé. Si un produit de contraste oral est utilisé, un produit de contraste hydrosoluble est préféré en cas d’extravasation du produit de contraste.
Bien que l’air libre soit très suspect en matière de perforation, des signes plus subtils de perforation intestinale avec ou sans air libre concomitant incluent des foyers localisés d’air extraluminal, des brins de graisse mésentérique, un épaississement de la paroi intestinale, du liquide extraluminal, un abcès extraluminal, une extravasation de produit de contraste. discontinuité des parois buccale et intestinale. De plus, de l’air libre peut être trouvé dans l’espace intrapéritonéal, rétropéritonéal ou extrapéritonéal, et son emplacement contribue en outre à élucider la zone de perforation le long de l’intestin dans les cas peu clairs, ce qui est utile pour la planification chirurgicale.
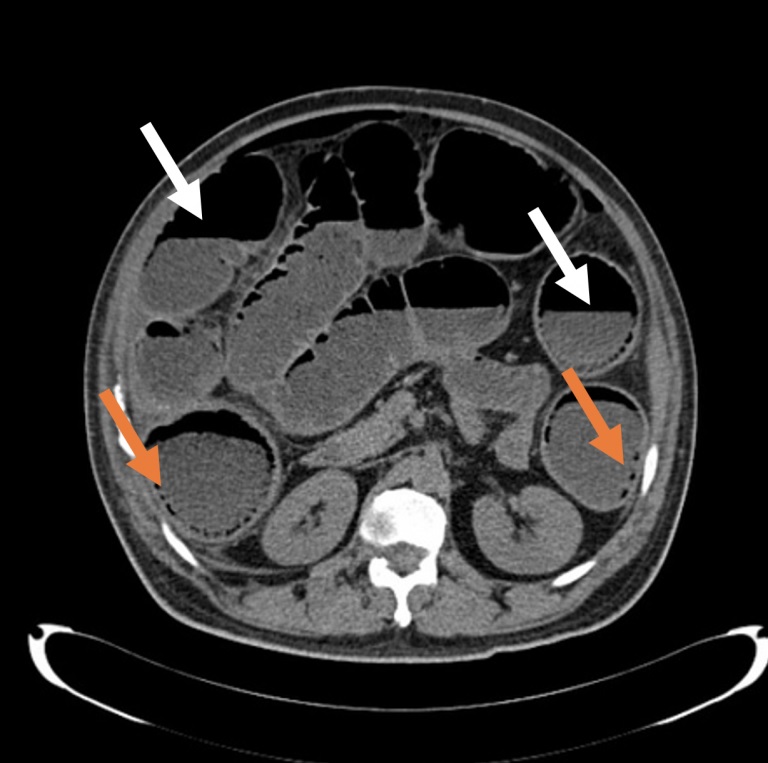
Figure 2 . Coupe axiale d’un scanner abdominal sans contraste montrant les niveaux air-liquide (flèches blanches) et plusieurs foyers d’air intra-muros (flèches orange).
Diagnostic différentiel
Plusieurs conditions peuvent imiter les résultats radiographiques de perforation au scanner. Plus précisément, les patients ayant subi une chirurgie abdominale récente auront un pneumopéritoine postopératoire pendant en moyenne deux semaines ; Les infections telles que la pyélonéphrite emphysémateuse ou la cholécystite emphysémateuse auront des foyers aériens ; un barotraumatisme, un pneumothorax ou un pneumomédiastin peuvent aspirer de l’air entre la paroi abdominale et le péritoine.
Bien que cette liste de diagnostics différentiels ne soit pas exhaustive, elle souligne la nécessité d’une anamnèse et d’un examen physique précis pour aider à corréler la suspicion clinique avec les données radiographiques.
Les modalités d’imagerie alternatives comprennent l’imagerie par résonance magnétique (IRM), qui est généralement plus coûteuse et moins disponible aux urgences, et l’échographie au chevet du patient. L’échographie dépend de l’utilisateur mais a une spécificité de 84 à 100 % et une sensibilité de 83 à 97 % pour reconnaître les obstructions de l’intestin grêle (SBO). Cependant, des complications telles qu’une perforation peuvent être plus difficiles à identifier par échographie.
Gestion
En cas d’obstruction de l’intestin grêle (SBO) non compliquée, un traitement médical comprenant des antiémétiques, des analgésiques, une optimisation électrolytique et un repos intestinal peuvent souvent résoudre l’obstruction. De plus, une sonde nasogastrique (NG) peut décompresser l’estomac et réduire les symptômes du patient. Il y a eu de nombreux débats sur l’utilité des tubes NG dans le SBO, mais il existe peu de données concernant les tubes NG en cas d’obstruction ou de perforation intestinale. L’insertion de sondes NG chez les patients symptomatiques, en particulier ceux présentant des vomissements actifs et une distension abdominale, peut être une stratégie raisonnable.
Chez tout patient présentant un processus obstructif, un remplacement liquidien par des cristalloïdes équilibrés tels que le Ringer lactate (LR), la correction de l’acidose si présente, le contrôle de la douleur et des nausées et l’optimisation des électrolytes sont nécessaires. Malheureusement, les données sur l’administration spécifique de liquides (libérale, restrictive ou ciblée) sont limitées, en particulier chez les patients subissant une chirurgie abdominale, et l’état clinique du patient doit dicter la gestion des liquides.
Cependant, contrairement aux obstructions simples, la perforation intestinale nécessite une consultation chirurgicale urgente pour une réparation chirurgicale.
Les antibiotiques à large spectre doivent également être instaurés tôt, couvrant idéalement les bactéries Gram-négatives et anaérobies. Une lésion de toute taille au niveau de la muqueuse intestinale (œdème, perforation, ischémie) peut provoquer la translocation de micro-organismes intestinaux et, en cas de défauts importants, un franc déversement fécal dans le péritoine.
Par conséquent, même si un patient ne semble pas septique, une couverture antibiotique prophylactique contre les bactéries Gram-négatives et anaérobies doit être administrée. Plus précisément, les médecins doivent couvrir les Enterobacteriaceae, Klebsiella et Enterococcus, avec une couverture supplémentaire pour les Staphylococcus (y compris le SARM) et les Pseudomonas chez les patients ayant récemment subi une instrumentation ou une hospitalisation. Les stratégies comprennent la pipéracilline-tazobactam 4,5 g en dose de charge avec 3,375 g administrés toutes les 8 heures, l’ertapénème 1 g toutes les 24 heures ou le métronidazole 1 g toutes les 12 heures + ciprofloxacine 400 mg toutes les 8 heures. L’ajout de vancomycine 20 mg/kg peut être ajouté pour couvrir le SARM, si nécessaire.
Résolution de l’affaire
La température rectale du patient a révélé une fièvre de 38,5 degrés. Après avoir reçu 2 litres de LR, ainsi que de l’acétaminophène et de la morphine, les signes vitaux du patient s’améliorent jusqu’à HR 95, TA 115/70 et température 36,5°.
Dès la reconnaissance d’une septicémie, un traitement empirique pipéracilline-tazobactam est démarré et des hémocultures et des tests de laboratoire sont effectués, qui renvoient avec un nombre de globules blancs de 22 000.
Parce que le patient est trop faible pour se tenir debout, ses radiographies thoraciques et abdominales en décubitus dorsal sont banales, mais un scanner ultérieur de l’abdomen et du bassin avec contraste intraveineux montre une occlusion perforée de l’intestin grêle.
Un chirurgien est consulté et le patient est admis pour réparation chirurgicale de sa perforation intestinale en salle d’opération.
Points clés
|















