Lecanemab nella malattia di Alzheimer precoce
Sfondo
L’accumulo di beta-amiloide (Aβ) aggregato solubile e insolubile può avviare o potenziare processi patologici nella malattia di Alzheimer. Il lecanemab, un anticorpo monoclonale umanizzato IgG1 che si lega con elevata affinità alle protofibrille Aβ solubili, è in fase di sperimentazione su persone con malattia di Alzheimer in fase iniziale.
Metodi
Abbiamo condotto uno studio di Fase 3, multicentrico, in doppio cieco, della durata di 18 mesi, coinvolgendo persone di età compresa tra 50 e 90 anni con malattia di Alzheimer precoce (decadimento cognitivo lieve o demenza lieve dovuta alla malattia di Alzheimer) con evidenza di amiloide alla tomografia a emissione di positroni (PET) o analisi del liquido cerebrospinale.
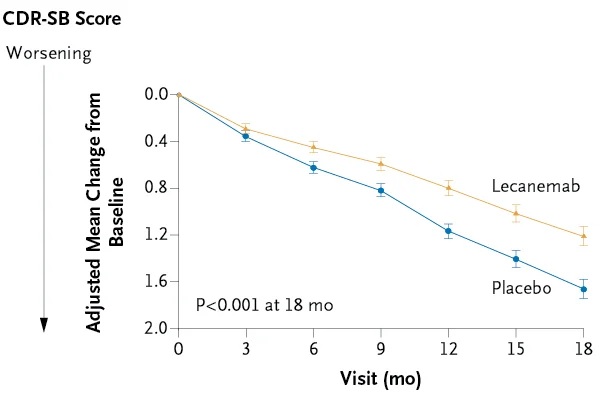
I partecipanti sono stati assegnati in modo casuale in un rapporto 1:1 a ricevere lecanemab per via endovenosa (10 mg per chilogrammo di peso corporeo ogni 2 settimane) o placebo. L’endpoint primario era la variazione dal basale a 18 mesi del punteggio Clinical Dementia Rating-Sum of Boxes (CDR-SB; range da 0 a 18, con punteggi più alti che indicano un maggiore peggioramento).
Gli endpoint secondari chiave erano il cambiamento del carico di amiloide alla PET, il punteggio sulla sottoscala cognitiva a 14 elementi dell’Alzheimer’s Disease Assessment Scale (ADAS-cog14; range da 0 a 90;
Risultati
Sono stati arruolati in totale 1.795 partecipanti , di cui 898 assegnati a ricevere lecanemab e 897 a ricevere placebo. Il punteggio medio CDR-SB al basale era di circa 3,2 in entrambi i gruppi.
La variazione della media dei minimi quadrati aggiustata dal basale a 18 mesi è stata di 1,21 con lecanemab e 1,66 con placebo (differenza, -0,45; intervallo di confidenza al 95% [CI], -0,67 a -0,23; P < 0,001).
In un sottostudio con 698 partecipanti, si sono verificate riduzioni maggiori del carico di amiloide nel cervello con lecanemab rispetto al placebo (differenza: -59,1 centloidi; IC al 95%, da -62,6 a -55,6).
Altre differenze medie tra i due gruppi nella variazione rispetto al basale a favore di lecanemab sono state le seguenti: per il punteggio ADAS-cog14, -1,44 (IC al 95%, da -2,27 a -0,61; P < 0,001); per ADCOMS, -0,050 (IC al 95%, da -0,074 a -0,027; P <0,001); e per il punteggio ADCS-MCI-ADL, 2,0 (IC al 95%, da 1,2 a 2,8; p<0,001).
Lecanemab ha causato reazioni correlate all’infusione nel 26,4% dei partecipanti e anomalie nell’imaging correlate all’amiloide con edema o versamento nel 12,6%.
Conclusioni Lecanemab ha ridotto i marcatori amiloidi nella fase iniziale della malattia di Alzheimer e ha comportato un declino moderatamente inferiore dei parametri cognitivi e funzionali rispetto al placebo a 18 mesi, ma è stato associato a eventi avversi . Sono necessari studi più lunghi per determinare l’efficacia e la sicurezza di lecanemab nella malattia di Alzheimer in fase iniziale. |
(Finanziato da Eisai e Biogen; numero Clarity AD ClinicalTrials.gov, NCT03887455. si apre in una nuova scheda.)















