Lecanemab bei früher Alzheimer-Krankheit
Hintergrund
Die Anhäufung von löslichem und unlöslichem aggregiertem Beta-Amyloid (Aβ) kann pathologische Prozesse bei der Alzheimer-Krankheit auslösen oder verstärken. Lecanemab, ein humanisierter monoklonaler IgG1-Antikörper, der mit hoher Affinität an lösliche Aβ-Protofibrillen bindet, wird an Menschen mit früher Alzheimer-Krankheit getestet.
Methoden
Wir führten eine 18-monatige, multizentrische, doppelblinde Phase-3-Studie mit Menschen im Alter von 50 bis 90 Jahren mit früher Alzheimer-Krankheit (leichte kognitive Beeinträchtigung oder leichte Demenz aufgrund der Alzheimer-Krankheit) durch, bei der in der Positronenemissionstomographie Amyloid nachgewiesen wurde (PET) oder Liquoranalyse.
Die Teilnehmer wurden im Verhältnis 1:1 nach dem Zufallsprinzip einer intravenösen Gabe von Lecanemab (10 mg pro Kilogramm Körpergewicht alle 2 Wochen) oder einem Placebo zugeteilt. Der primäre Endpunkt war die Veränderung des Clinical Dementia Rating-Sum of Boxes (CDR-SB; Bereich 0 bis 18, wobei höhere Werte auf eine stärkere Verschlechterung hinweisen) vom Ausgangswert auf 18 Monate.
Wichtige sekundäre Endpunkte waren die Veränderung der Amyloidbelastung bei der PET, der Score auf der 14-Punkte-kognitiven Subskala der Alzheimer-Krankheitsbewertungsskala (ADAS-cog14; Bereich: 0 bis 90;
Ergebnisse
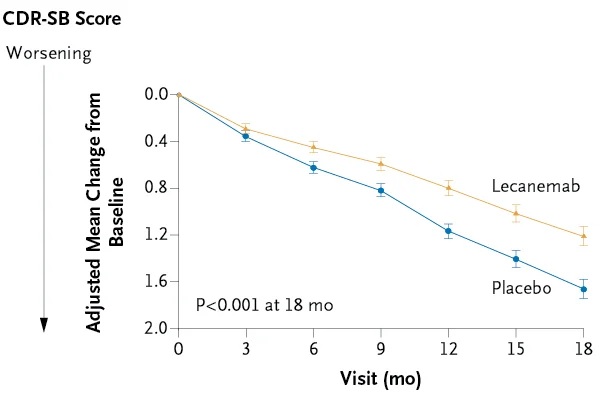
Insgesamt waren 1.795 Teilnehmer eingeschrieben, von denen 898 Lecanemab und 897 ein Placebo erhielten. Der mittlere CDR-SB-Score zu Studienbeginn betrug in beiden Gruppen etwa 3,2.
Die angepasste mittlere Änderung der kleinsten Quadrate vom Ausgangswert bis zu 18 Monaten betrug 1,21 mit Lecanemab und 1,66 mit Placebo (Differenz –0,45; 95 %-Konfidenzintervall [KI] –0,67 a –0,23; P < 0,001).
In einer Teilstudie mit 698 Teilnehmern kam es unter Lecanemab zu einer stärkeren Verringerung der Amyloidbelastung im Gehirn als unter Placebo (Unterschied: -59,1 Zentiloide; 95 %-KI: -62,6 bis -55,6).
Weitere mittlere Unterschiede zwischen den beiden Gruppen in der Veränderung gegenüber dem Ausgangswert zugunsten von Lecanemab waren wie folgt: für den ADAS-cog14-Score –1,44 (95 %-KI –2,27 bis –0,61; P < 0,001); für ADCOMS –0,050 (95 %-KI –0,074 bis –0,027; p < 0,001); und für den ADCS-MCI-ADL-Score 2,0 (95 %-KI 1,2 bis 2,8; p < 0,001).
Lecanemab verursachte bei 26,4 % der Teilnehmer infusionsbedingte Reaktionen und bei 12,6 % Amyloid-bedingte Bildstörungen mit Ödemen oder Ergüssen.
Schlussfolgerungen Lecanemab reduzierte die Amyloidmarker im Frühstadium der Alzheimer-Krankheit und führte nach 18 Monaten zu einem mäßig geringeren Rückgang der kognitiven und funktionellen Messwerte als Placebo, war jedoch mit unerwünschten Ereignissen verbunden . Um die Wirksamkeit und Sicherheit von Lecanemab bei der frühen Alzheimer-Krankheit zu bestimmen, sind längere Studien erforderlich. |
(Gefördert von Eisai und Biogen; Clarity AD ClinicalTrials.gov-Nummer, NCT03887455. Wird in neuem Tab geöffnet.)















