Lécanemab au stade précoce de la maladie d’Alzheimer
Arrière-plan
L’accumulation de bêta-amyloïde agrégé (Aβ) soluble et insoluble peut initier ou potentialiser des processus pathologiques dans la maladie d’Alzheimer. Le lécanemab, un anticorps monoclonal IgG1 humanisé qui se lie avec une forte affinité aux protofibrilles Aβ solubles, est testé chez des personnes atteintes d’un stade précoce de la maladie d’Alzheimer.
Méthodes
Nous avons mené un essai de phase 3, multicentrique, en double aveugle, d’une durée de 18 mois, impliquant des personnes âgées de 50 à 90 ans atteintes d’un stade précoce de la maladie d’Alzheimer (déficience cognitive légère ou démence légère due à la maladie d’Alzheimer) avec des preuves d’amyloïde sur la tomographie par émission de positons. (PET) ou analyse du liquide céphalo-rachidien.
Les participants ont été répartis au hasard selon un rapport de 1 : 1 pour recevoir du lécanemab par voie intraveineuse (10 mg par kilogramme de poids corporel toutes les 2 semaines) ou un placebo. Le critère d’évaluation principal était le changement entre l’inclusion et 18 mois du score Clinical Dementia Rating-Sum of Boxes (CDR-SB ; plage de 0 à 18, des scores plus élevés indiquant une plus grande détérioration).
Les principaux critères d’évaluation secondaires étaient la modification de la charge amyloïde à la TEP, le score sur la sous-échelle cognitive à 14 éléments de l’échelle d’évaluation de la maladie d’Alzheimer (ADAS-cog14 ; plage de 0 à 90 ;
Résultats
Au total, 1 795 participants ont été inscrits, dont 898 ont reçu du lécanemab et 897 ont reçu un placebo. Le score CDR-SB moyen au départ était d’environ 3,2 dans les deux groupes.
La variation moyenne ajustée des moindres carrés entre l’inclusion et 18 mois était de 1,21 avec le lécanemab et de 1,66 avec le placebo (différence : −0,45 ; intervalle de confiance [IC] à 95 %, −0,67 à −0,23 ; P < 0,001).
Dans une sous-étude portant sur 698 participants, il y a eu des réductions plus importantes de la charge amyloïde cérébrale avec le lécanemab qu’avec le placebo (différence, -59,1 centiloïdes ; IC à 95 %, -62,6 à -55,6).
Les autres différences moyennes entre les deux groupes dans l’évolution par rapport à l’inclusion en faveur du lécanemab étaient les suivantes : pour le score ADAS-cog14, −1,44 (IC 95 %, −2,27 à −0,61 ; P < 0,001) ; pour ADCOMS, −0,050 (IC à 95 %, −0,074 à −0,027 ; P <0,001) ; et pour le score ADCS-MCI-ADL, 2,0 (IC à 95 %, 1,2 à 2,8 ; p<0,001).
Le lécanemab a provoqué des réactions liées à la perfusion chez 26,4 % des participants et des anomalies d’imagerie liées à l’amyloïde avec œdème ou épanchement chez 12,6 %.
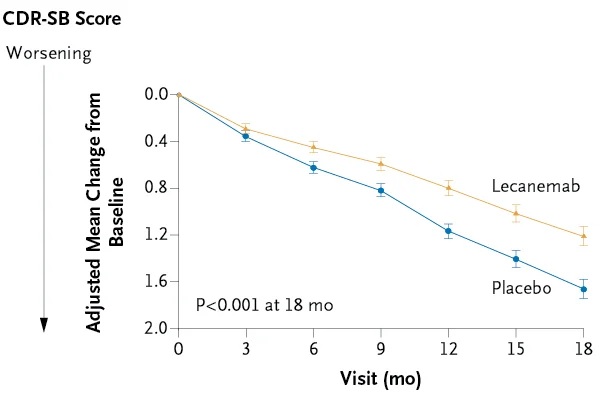
Conclusions Le lécanemab a réduit les marqueurs amyloïdes au début de la maladie d’Alzheimer et a entraîné une diminution modérément moindre des mesures de la cognition et de la fonction que le placebo à 18 mois, mais a été associé à des événements indésirables . Des essais plus longs sont nécessaires pour déterminer l’efficacité et l’innocuité du lécanemab au stade précoce de la maladie d’Alzheimer. |
(Financé par Eisai et Biogen ; numéro Clarity AD ClinicalTrials.gov, NCT03887455. s’ouvre dans un nouvel onglet.)















