Einführung
Unter Sepsis versteht man eine lebensbedrohliche Funktionsstörung eines Organs, die durch eine gestörte Reaktion des Wirts auf eine Infektion verursacht wird.
In diesem Zusammenhang könnten Biomarker als Indikatoren für eine Infektion, eine fehlregulierte Reaktion des Wirts oder eine Reaktion auf die Behandlung betrachtet werden und/oder Ärzten helfen, das Patientenrisiko vorherzusagen.
In der täglichen Praxis kombinieren Ärzte für die Diagnose und Behandlung von Sepsis sowie für die Verabreichung von Antibiotika Daten aus verschiedenen Quellen, die sich aus der Schnittmenge von drei Vektoren ergeben ( Abb. 1 ): systemische Manifestationen , Organdysfunktion und mikrobiologische Dokumentation . Biomarker könnten zusätzliche Informationen über den Vektor systemischer Manifestationen (Wirtsreaktions-Biomarker, z. B. C-reaktives Protein-CRP und Procalcitonin-PCT), Organfunktionsstörungen (z. B. Nierenschädigungs-Biomarker) und mikrobiologische Dokumentation (erregerspezifische Biomarker ) liefern.
Ungefähr 40–50 % der Sepsisfälle gelten als kulturnegativ. Biomarker wurden im Zusammenhang mit der Sepsis-Vorhersage, der Sepsis-Diagnose, der Beurteilung des Sepsis-Ansprechens auf die Therapie und der Biomarker-gesteuerten Antibiotikatherapie untersucht. Darüber hinaus können Sepsis-Biomarker in prognostische, prädiktive und theranostische unterteilt werden, d. h. als Orientierungshilfe für Wahl, Dosis und Dauer der Therapie ( Abb. 1 ).
Das Ziel dieser Überprüfung besteht darin, Ärzte über Biomarker für Infektionen oder Sepsis zu informieren und Leitlinien für deren Verwendung bereitzustellen, nämlich pathogenspezifische Biomarker und zwei Biomarker für die Wirtsreaktion, PCT und CRP.
Wie nutzt man Biomarker?
Bei Verdacht auf Sepsis muss der Arzt mehrere Fragen beantworten:
1) Wie hoch ist die Wahrscheinlichkeit einer Infektion?
2) Wie schwer ist die Erkrankung und wie hoch ist das Risiko, einen septischen Schock zu entwickeln?
3) Was sind die wahrscheinlichsten Krankheitserreger?
4) Welche antimikrobielle Behandlung ist am besten geeignet?
5) Geht es dem Patienten besser oder nicht, und wenn nicht, warum?
6) Wann können antimikrobielle Mittel abgesetzt werden?
Ärzte versuchen oft, diese Fragen mit Hilfe von Biomarkern zu beantworten, aber es ist wichtig zu erkennen, dass ihre Leistung bei der Behandlung von Sepsis nicht optimal ist.
Pathogenspezifische und Wirtsreaktions-Biomarker
Biomarker werden als biologische Merkmale beschrieben, die objektiv gemessen und als Ersatzaufzeichnung eines physiologischen oder pathologischen Prozesses oder als Indikator für die Aktivität eines Arzneimittels verwendet werden. Im vorliegenden Zusammenhang könnten Biomarker für Infektionen und Sepsis als Indikatoren für eine Infektion oder eine fehlregulierte Wirtsreaktion oder Reaktion auf die Behandlung betrachtet werden.
Erregerspezifische Biomarker
Obwohl der Nachweis mikrobieller Nukleinsäuren immer häufiger vorkommt, bleibt ihr Stellenwert bei der Behandlung von Infektionen im Allgemeinen und bei bakteriellen Infektionen im Besonderen ungewiss und noch nicht gut standardisiert. Erregerspezifische Biomarker, wie zum Beispiel direkte Antigentests, werden bei kritisch kranken Patienten bereits häufig eingesetzt.
Die meisten antigenbasierten Schnelltests basieren auf immunchromatographischen Tests und können möglicherweise am Krankenbett eingesetzt werden. Atemwegs-Antigentests auf Influenza und SARS-CoV-2 sowie Urin-Antigentests auf Streptococcus pneumoniae und Legionella spp. Sie werden bei ambulant erworbener Pneumonie (CAP) eingesetzt. Sie weisen eine hohe Spezifität, aber eine geringe bis mäßige Empfindlichkeit auf.
Legionella-Antigentests weisen die Serogruppe 1 von Legionella pneumophila nach . Obwohl dies die Hauptursache für Legionellose ist, treten bei anderen Serogruppen oder Arten falsch negative Ergebnisse auf.
Eine Clostridioides-difficile- Infektion (CDI) kann bei symptomatischen Patienten mithilfe eines zweistufigen Algorithmus mit schnellen Enzymimmunoassays diagnostiziert werden, um Stuhlproben sowohl auf Glutamatdehydrogenase (GDH) als auch auf die freien Toxine A und B zu analysieren. Niedrige positive Vorhersagewerte bei niedriger CDI-Prävalenz soll verhindern, dass der Test allein verwendet wird. Der GDH-Test ist sehr empfindlich und wird bei positivem Ergebnis mit dem spezifischeren Toxin-A/B-Test kombiniert.
Pilzantigen-Assays zielen auf strukturelle Polysaccharide ab, die aus Pilzzellwänden stammen. (1,3)-β-D-Glucan (BDG) ist ein Pan-Pilz-Serumbiomarker, der häufig zum Nachweis invasiver Candidiasis verwendet wird. Mit hoher Sensitivität, aber geringer Spezifität ist BDG ein wertvolles Instrument zum Ausschluss einer invasiven Candidose auf Intensivstationen (ICUs) mit geringer Prävalenz.
Eine kürzlich durchgeführte randomisierte klinische Studie (RCT) konnte jedoch keine Überlebensvorteile einer frühen Einleitung einer BDG-gesteuerten antimykotischen Therapie bei kritisch kranken septischen Patienten mit geringem bis mittlerem Risiko einer invasiven Candidiasis und auf Kosten einer erheblichen Überbeanspruchung nachweisen. von Antimykotika.
Galactomannan (GM) kann in Serum- und bronchoalveolären Lavageproben (BAL) gemessen werden und zeigt eine hohe Spezifität für die Diagnose der invasiven pulmonalen Aspergillose (IPA). Bemerkenswert ist, dass der BAL-Flüssigkeits-GM-Test zur Diagnose von IPA bei nicht-neutropenischen Patienten empfindlicher ist als der Serumtest und dieser Test eine zentrale Rolle bei den Diagnosekriterien für IPA bei Schwerkranken spielt.
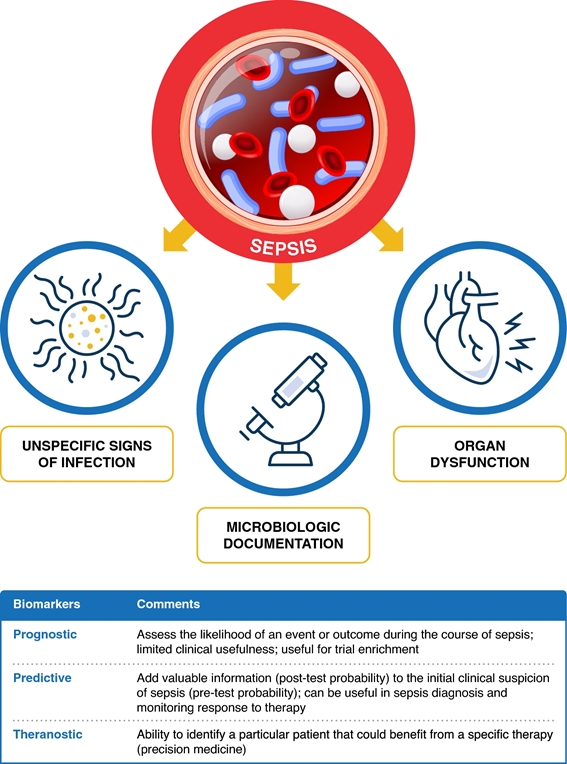
Abbildung 1. Die drei Vektoren des Ansatzes zur Sepsis: systemische Manifestationen, organische Dysfunktion und mikrobiologische Dokumentation (siehe Text). Biomarker könnten zusätzliche Informationen zu systemischen Manifestationen des Vektors (Wirtsreaktions-Biomarker, z. B. C-reaktives Protein-CRP und Procalcitonin-PCT), Organfunktionsstörungen (z. B. Biomarker für Nierenschäden) und mikrobiologischer Dokumentation (erregerspezifische Biomarker) liefern. Biomarker können in prognostische, prädiktive und theranostische Biomarker eingeteilt werden.
Biomarker der Wirtsreaktion
Im nächsten Abschnitt analysieren wir zwei Biomarker der Wirtsreaktion, PCT und CRP.
PROCALCITONIN
Procalcitonin ist eine Prohormon-Vorstufe von Calcitonin. PCT wird von fast allen Organen und Makrophagen produziert und seine Konzentration beginnt 3–4 Stunden nach einem Entzündungsreiz anzusteigen und erreicht etwa 24 Stunden lang einen Höhepunkt.
Vorhersage einer Sepsis : PCT ist der am besten untersuchte Biomarker im Zusammenhang mit beatmungsassoziierter Pneumonie (VAP). Studien zur PCT-Kinetik bei kritisch kranken Patienten zeigten eine geringe diagnostische Genauigkeit und geringe Auswirkungen auf die Leitlinien für den Therapiebeginn. Daher ist der Nutzen der PCT bei der Vorhersage einer Sepsis auf der Intensivstation begrenzt, obwohl sie in ausgewählten Situationen mit einem verringerten Antibiotikaeinsatz einhergeht.
Diagnose einer Sepsis : In veröffentlichten Studien wurde weder der Grenzwert angegeben, noch wurden Werte im Bereich von 0,5 bis 2 μg/L verwendet. Obwohl PCT CRP bei Patienten mit Verdacht auf Sepsis überlegen sein kann, sollte PCT nicht als Leitfaden für die Verschreibung antimikrobieller Mittel herangezogen werden. Ebenso wird die Verwendung von PCT zur Diagnose von VAP nicht empfohlen.
Bewertung des Ansprechens der Sepsis auf die Therapie: Bei Patienten mit VAP könnte der zu Studienbeginn und am Tag 4 der Behandlung gemessene PCT das Überleben vorhersagen und zwischen Patienten mit guten und schlechten Ergebnissen unterscheiden. In der klinischen Praxis sollten Patienten, die unter einer Antibiotikatherapie anhaltend erhöhte D3/D4-Biomarkerwerte aufweisen, den Verdacht eines Behandlungsversagens erwecken und eine aggressive Diagnose und Behandlung veranlassen. Allerdings ist Vorsicht geboten, wenn Biomarker als unabhängiges Kriterium für die Entscheidung, wann die Diagnose eskaliert werden soll, herangezogen werden.
PCT-gesteuerte Antibiotikatherapie: Ein immer beliebter werdender Ansatz ist die Verwendung von Biomarkern zur Personalisierung der Dauer einer Antibiotikabehandlung. Dieser Ansatz berücksichtigt die Reaktion des einzelnen Patienten auf die Therapie und passt das Absetzen der Antibiotika an den tatsächlichen klinischen Verlauf des Patienten an.
Bisher gibt es starke Belege für die Bewertung der PCT-gesteuerten Antibiotikatherapie bei kritisch kranken Patienten, die bestätigen, dass diese Strategie sicher ist, mit einer kürzeren Therapiedauer verbunden ist und in einigen RCTs die Mortalität senkt. Die Hauptkritikpunkte waren jedoch, dass in den Kontrollen der ersten Studien die Dauer der Antibiotikatherapie länger war als empfohlen.
C-REAKTIVES PROTEIN
Serum-CRP ist ein Akute-Phase-Protein, das ausschließlich in der Leber als Reaktion auf Zytokine synthetisiert wird. Seine Werte beginnen 4–6 Stunden nach einem Entzündungsreiz anzusteigen und werden nicht durch Immunsuppression (Steroide oder Neutropenie) oder Nierenversagen beeinflusst. oder Nierenersatztherapie und unterscheidet sich nicht wesentlich zwischen Personen mit und ohne Zirrhose.
Sepsis-Vorhersage : Ein ähnlicher Befund wurde in einer großen Studie zu ambulant erworbenen Blutkreislaufinfektionen (BSI) beobachtet, bei der die CRP-Konzentration in den drei Tagen vor einer endgültigen Diagnose zu steigen begann.
Diagnose einer Sepsis: Der Wert einer einzelnen CRP-Bestimmung bei Patienten mit Verdacht auf Sepsis wurde nicht konsistent nachgewiesen. In einer aktuellen prospektiven Beobachtungsstudie, der CAPTAIN-Studie, in der die Leistung von 53 Biomarkern bei der Unterscheidung zwischen Sepsis und nicht-septischem systemischem Entzündungsreaktionssyndrom (SIRS) bewertet wurde, wurde jedoch festgestellt, dass kein Biomarker oder keine Kombination besser abschneidet als CRP. allein und besser als PCT.
Bewertung der Reaktion der Sepsis auf die Therapie: Die Verwendung relativer CRP-Variationen (CRP-Verhältnis), das Verhältnis der CRP-Konzentration jedes Tages im Verhältnis zum Spiegel am Tag 0 (D0), war am aussagekräftigsten als die absoluten Änderungen von CRP. Ein starker Rückgang des CRP-Index ist ein Surrogatindikator für die Auflösung der Sepsis, während ein anhaltend erhöhter oder steigender CRP-Index darauf hindeutet, dass die Sepsis therapierefraktär ist.
PCR-gesteuerte Antibiotikatherapie: Die Anzahl der RCTs, die die PCR-gesteuerte Strategie evaluieren, ist begrenzt, insbesondere bei Intensivpatienten. Beobachtungs- und randomisierte Studien haben ergeben, dass die von CRP gesteuerte Strategie im Vergleich zu der von PCT oder fester Dauer (kurzer Kurs) gesteuerten Strategie keine wesentlichen Unterschiede in der Fähigkeit aufwies, Verbesserungen (oder Verschlechterungen) im klinischen Verlauf von Sepsis und Schock widerzuspiegeln. septisch und bei der Reduzierung der Antibiotikaexposition
Eine individualisierte Therapie würde darin bestehen, eine feste Dauer mit Biomarker-Anleitung zu kombinieren und dabei eine „Doppel-Trigger“-Strategie zu verwenden. Nach einigen Tagen der Therapie können die Antibiotika entsprechend dem klinischen Verlauf und dem Rückgang der Biomarkerwerte (CRP oder PCT) gemäß einem vordefinierten Algorithmus abgesetzt werden oder es können 5 bis 7 volle Tage der Therapie mit Antibiotika abgeschlossen werden, je nachdem, was zuerst eintritt ( Abb.2 ). Diese individualisierte Strategie wurde in mehreren RCTs evaluiert und zeigte, dass die Biomarker-Führung die Therapiedauer im Vergleich zur festen Therapiedauer sicher verkürzen kann.
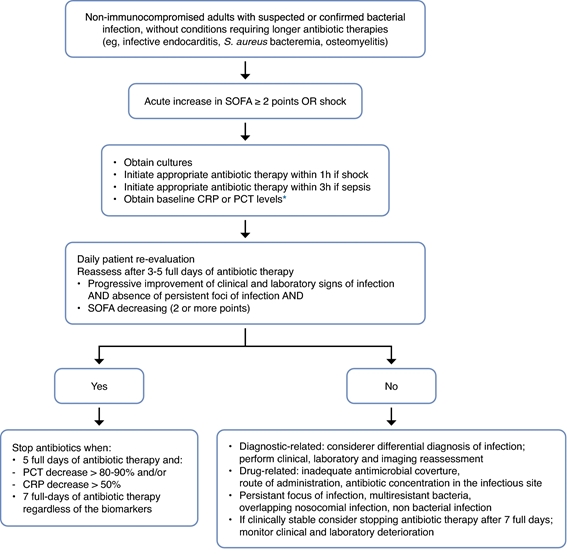
Abbildung 2. Benutzerhandbuch für die Biomarker-gesteuerte Antibiotikatherapie. Die Einleitung einer Antibiotikagabe bei kritisch kranken Patienten mit Verdacht auf Sepsis sollte unabhängig von der Höhe eines Biomarkers erfolgen. Dies muss jedoch täglich neu bewertet werden. Nutzen Sie den klinischen Verlauf, den Verlauf der Organfunktionsstörung (mit SOFA-Score), die Biomarkerkinetik und die Dauer der Antibiotikatherapie, um die optimale Therapiedauer zu bestimmen. Diese Empfehlungen gelten nicht für immungeschwächte Patienten oder Patienten mit Infektionen, die eine langfristige Antibiotikatherapie erfordern, wie z. B. Endokarditis oder Osteomyelitis.
Zukunftsperspektiven
Die Kombination mehrerer Biomarker zur Erstellung eines diagnostischen Panels hat sich bei der Sepsis-Diagnose nicht als durchweg überlegen gegenüber einem einzelnen Biomarker erwiesen. Dies ergibt sich aus der Tatsache, dass Sepsis-Biomarker oft stark korrelieren und daher die diagnostische Genauigkeit nicht verbessert wird, wenn diese Tests kombiniert werden.
Die diagnostische Genauigkeit eines Panels von Biomarkern hängt außerdem davon ab, wie die Ergebnisse einzelner Tests gewichtet werden und wie viele positiv sein müssen, damit das Gesamtpanel das Vorliegen einer Sepsis anzeigt. Beispielsweise kann ein Biomarker-Panel relativ empfindlich (nur ein einzelner Test muss „positiv“ sein) oder relativ spezifisch (alle einzelnen Tests müssen positiv sein) sein, je nachdem, wie das Panel interpretiert wird.
Allerdings haben sich Algorithmen, die Biomarker mit klinischen Daten kombinieren, als vielversprechend bei der Identifizierung von Patienten mit Sepsis in der Notaufnahme erwiesen. Ein solcher Algorithmus, der klinische Variablen und eine Reihe von Biomarkern kombiniert, ergab in einer Kohorte von 158 Patienten einen negativen Vorhersagewert von 100 % und einen positiven Vorhersagewert von 93 %.
Schlussfolgerungen Um von unserem aktuellen Stand der Sepsis-Biomarker zu einem Punkt zu gelangen, an dem wir über klinisch nützliche Marker verfügen, die die Behandlungspfade der Patienten vorantreiben und so die Ergebnisse verbessern, ist eine deutliche Änderung des Ansatzes erforderlich. Eindimensionale Studien von einem einzigen Zentrum aus dürften kaum große Fortschritte bringen. Benötigt werden große multizentrische Kohortenstudien, die modernste Algorithmen verwenden, um Biomarker zu identifizieren, die unterschiedliche Reaktionen auf Interventionen bei bestimmten klinischen Endotypen vorhersagen. Die Kombination vorhandener Tools in multizentrischen und multidisziplinären Kooperationen wird der effektivste Weg sein, neue Biomarker zu entdecken, die in der klinischen Praxis eingesetzt werden können, um die Patientenversorgung zu optimieren. Bis dahin können Sepsis-Biomarker nützliche ergänzende Instrumente sein, wenn Ärzte zusätzliche Informationen benötigen, um die Patientenversorgung am Krankenbett zu optimieren. Serienbestimmungen sind aussagekräftiger als ein einzelner Wert und Biomarker sollten niemals als eigenständiger Test, sondern immer in Verbindung mit einer gründlichen klinischen Bewertung verwendet werden. |
















