La septicémie est définie comme un dysfonctionnement d’un organe potentiellement mortel, provoqué par une réponse dérégulée de l’hôte à une infection.
Dans ce contexte, les biomarqueurs pourraient être considérés comme des indicateurs d’infection, de réponse dérégulée de l’hôte, de réponse au traitement et/ou aider les cliniciens à prédire le risque pour le patient.
Dans la pratique quotidienne, pour le diagnostic et la prise en charge du sepsis, ainsi que pour l’administration d’antibiotiques, les médecins combinent des données provenant de différentes sources qui résultent de l’intersection de trois vecteurs ( Fig. 1 ) : manifestations systémiques , dysfonctionnement d’organes et documentation microbiologique . Les biomarqueurs pourraient fournir des informations supplémentaires sur le vecteur des manifestations systémiques (biomarqueurs de la réponse de l’hôte, par exemple protéine C-réactive-CRP et procalcitonine-PCT), le dysfonctionnement d’un organe (par exemple, biomarqueurs de lésions rénales) et la documentation microbiologique ( biomarqueurs spécifiques d’un agent pathogène).
Environ 40 à 50 % des cas de sepsis sont considérés comme des cultures négatives. Les biomarqueurs ont été étudiés dans le contexte de la prédiction du sepsis, du diagnostic du sepsis, de l’évaluation de la réponse du sepsis au traitement et de l’antibiothérapie guidée par des biomarqueurs. De plus, les biomarqueurs du sepsis peuvent être divisés en pronostiques, prédictifs et théranostiques, c’est-à-dire pour guider le choix, la dose et la durée du traitement ( Fig. 1 ).
L’ objectif de cette revue est d’informer les cliniciens sur les biomarqueurs d’infection ou de sepsis et de fournir des conseils sur leur utilisation, à savoir les biomarqueurs spécifiques de l’agent pathogène et deux biomarqueurs de réponse de l’hôte, PCT et CRP.
Comment utiliser les biomarqueurs ?
Lorsqu’un sepsis est suspecté, le clinicien se pose plusieurs questions :
1) Quelle est la probabilité d’infection ?
2) Quelle est la gravité de la maladie et le risque de développer un choc septique ?
3) Quels sont les agents pathogènes les plus probables ?
4) Quel est le traitement antimicrobien le plus approprié ?
5) L’état du patient s’améliore-t-il ou non, et si non, pourquoi ?
6) Quand peut-on arrêter les antimicrobiens ?
Les médecins tentent souvent de répondre à ces questions à l’aide de biomarqueurs, mais il est important de reconnaître que leurs performances dans la gestion du sepsis sont sous-optimales.
Biomarqueurs spécifiques du pathogène et de la réponse de l’hôte
Les biomarqueurs sont décrits comme une caractéristique biologique, mesurée objectivement et utilisée comme enregistrement de substitution d’un processus physiologique ou pathologique, ou comme indicateur de l’activité d’un médicament. Dans le contexte actuel, les biomarqueurs de l’infection et du sepsis pourraient être considérés comme des indicateurs d’une infection ou d’une réponse dérégulée de l’hôte ou d’une réponse au traitement.
Biomarqueurs spécifiques aux agents pathogènes
Bien que la détection des acides nucléiques microbiens soit de plus en plus courante, sa place dans la prise en charge des infections en général, et des infections bactériennes en particulier, reste incertaine et pas encore bien standardisée. Les biomarqueurs spécifiques d’un agent pathogène, tels que les tests directs d’antigène, sont déjà largement utilisés chez les patients gravement malades.
La plupart des tests rapides basés sur les antigènes sont basés sur des tests immunochromatographiques et peuvent être utilisés au chevet du patient. Tests d’antigène respiratoire pour la grippe et le SRAS-CoV-2, et tests d’antigène urinaire pour Streptococcus pneumoniae et Legionella spp. Ils sont utilisés dans la pneumonie acquise en communauté (PAC). Ils ont une spécificité élevée mais une sensibilité faible à modérée.
Les tests antigéniques de Legionella détectent Legionella pneumophila sérogroupe 1. Bien qu’il s’agisse de la cause prédominante de la légionellose, des faux négatifs se produisent avec d’autres sérogroupes ou espèces.
L’infection à Clostridioides difficile (ICD) peut être diagnostiquée chez les patients symptomatiques, à l’aide d’un algorithme en deux étapes avec des tests immunoenzymatiques rapides pour analyser des échantillons de selles à la fois pour la glutamate déshydrogénase (GDH) et les toxines libres A et B. Faibles valeurs prédictives positives avec une faible prévalence d’ICD. devrait empêcher que le test soit utilisé seul. Le test GDH est très sensible et, s’il est positif, est associé au test toxine A/B plus spécifique.
Les tests d’antigènes fongiques ciblent les polysaccharides structuraux dérivés des parois cellulaires fongiques. Le (1,3)-β-D-glucane (BDG) est un biomarqueur sérique panfongique couramment utilisé pour détecter la candidose invasive. Avec une sensibilité élevée, mais une faible spécificité, le BDG est un outil précieux pour exclure la candidose invasive dans les unités de soins intensifs (USI) à faible prévalence.
Cependant, un récent essai clinique randomisé (ECR) n’a pas réussi à démontrer les bénéfices en termes de survie d’une initiation précoce d’un traitement antifongique guidé par le BDG chez des patients septiques gravement malades présentant un risque faible à intermédiaire de candidose invasive, et au prix d’une surutilisation importante. d’antifongiques.
Le galactomannane (GM) peut être mesuré dans des échantillons de sérum et de lavage broncho-alvéolaire (LBA) et présente une spécificité élevée pour le diagnostic de l’aspergillose pulmonaire invasive (IPA). Il convient de noter que le test GM du fluide BAL est plus sensible que le test sérique pour diagnostiquer l’IPA chez les patients non neutropéniques, et ce test joue un rôle central dans les critères de diagnostic de l’IPA chez les personnes gravement malades.
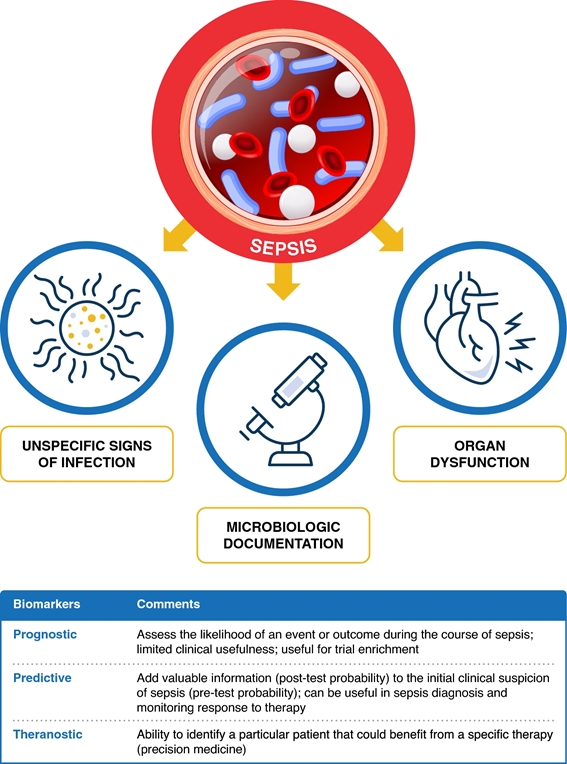
Figure 1. Les trois vecteurs de l’approche du sepsis : manifestations systémiques, dysfonctionnement organique et documentation microbiologique (voir texte). Les biomarqueurs pourraient fournir des informations supplémentaires sur les manifestations systémiques du vecteur (biomarqueurs de la réponse de l’hôte, par exemple protéine C-réactive-CRP et procalcitonine-PCT), le dysfonctionnement d’un organe (par exemple, biomarqueurs de lésions rénales) et la documentation microbiologique (biomarqueurs spécifiques à l’agent pathogène). Les biomarqueurs peuvent être classés comme pronostiques, prédictifs et théranostiques.
Biomarqueurs de réponse de l’hôte
Dans la section suivante, nous analysons deux biomarqueurs de la réponse de l’hôte, PCT et CRP.
PROCALCITONINE
La procalcitonine est un précurseur prohormone de la calcitonine. La PCT est produite par presque tous les organes et macrophages, et ses niveaux commencent à augmenter 3 à 4 heures après un stimulus inflammatoire, atteignant un pic vers 24 heures.
Prédiction du sepsis : La PCT est le biomarqueur le plus étudié dans le cadre de la pneumonie nosocomiale (PAV). Les études sur la cinétique de la PCT chez des patients gravement malades ont montré une faible précision du diagnostic et un faible impact sur les conseils pour l’initiation du traitement. Par conséquent, bien qu’elle soit associée à une diminution de l’utilisation d’antibiotiques dans certains contextes, l’utilité de la PCT pour prédire le sepsis en USI est limitée.
Diagnostic du sepsis : Les études publiées n’ont pas rapporté de valeur seuil ou ont utilisé des valeurs allant de 0,5 à 2 μg/L. Bien que la PCT puisse être supérieure à la CRP chez les patients suspectés de sepsis, la PCT ne doit pas être utilisée pour guider la prescription d’antimicrobiens. De même, ils ne recommandent pas l’utilisation de la PCT pour le diagnostic de PAV.
Évaluation de la réponse du sepsis au traitement : chez les patients atteints de PAV, la PCT mesurée au départ et à J4 du traitement pourrait prédire la survie, en différenciant les patients avec de bons et de mauvais résultats. Dans la pratique clinique, les patients qui présentent des taux de biomarqueurs D3/D4 constamment élevés sous antibiothérapie devraient faire suspecter un échec du traitement et devraient inciter à un diagnostic et à un traitement agressifs. Cependant, il convient d’être prudent lors de l’utilisation des biomarqueurs comme critère indépendant pour décider du moment où il convient d’intensifier le diagnostic.
Antibiothérapie guidée par PCT : une approche de plus en plus populaire consiste à utiliser des biomarqueurs pour personnaliser la durée du traitement antibiotique. Cette approche inclut la réponse individuelle du patient au traitement, en faisant correspondre l’arrêt des antibiotiques à l’évolution clinique réelle du patient.
À ce jour, il existe des preuves solides évaluant l’antibiothérapie guidée par PCT chez des patients gravement malades, confirmant que cette stratégie est sûre, est associée à une durée de traitement plus courte et, dans certains ECR, réduit la mortalité. Cependant, les principales critiques concernaient le fait que, lors des contrôles des premiers essais, la durée de l’antibiothérapie était plus longue que celle recommandée.
PROTÉINE C-RÉACTIVE
La CRP sérique est une protéine de phase aiguë synthétisée exclusivement dans le foie en réponse aux cytokines. Ses niveaux commencent à augmenter 4 à 6 heures après un stimulus inflammatoire et ne sont pas influencés par l’immunosuppression (stéroïdes ou neutropénie) ou par l’insuffisance rénale. ou un traitement de remplacement rénal, et ne diffère pas significativement entre les individus avec ou sans cirrhose.
Prédiction du sepsis : Un résultat similaire a été observé dans une vaste étude sur les infections sanguines nosocomiales (BSI) dans laquelle la concentration de CRP a commencé à augmenter au cours des trois jours précédant un diagnostic définitif.
Diagnostic du sepsis : l’intérêt d’une détermination unique de la CRP chez les patients suspectés de sepsis n’a pas été systématiquement démontré. Cependant, dans une étude observationnelle prospective récente, l’étude CAPTAIN, qui a évalué les performances de 53 biomarqueurs pour distinguer le sepsis du syndrome de réponse inflammatoire systémique non septique (SIRS), il a été constaté qu’aucun biomarqueur ou combinaison n’était plus performant que la CRP. seul, et mieux que PCT.
Évaluation de la réponse du sepsis au traitement : l’ utilisation des variations relatives de la CRP (rapport CRP), le rapport de la concentration de CRP de chaque jour par rapport au niveau au jour 0 (J0), était plus informative que les changements absolus du CRP. Une forte diminution de l’indice CRP est un marqueur substitut de la résolution du sepsis, tandis qu’un indice CRP constamment élevé ou en augmentation suggère que le sepsis est réfractaire au traitement.
Antibiothérapie guidée par PCR : le nombre d’ECR évaluant la stratégie guidée par PCR est limité, en particulier chez les patients en soins intensifs. Des études observationnelles et randomisées ont montré que la stratégie guidée par la CRP par rapport à celle guidée par la PCT ou une durée fixe (cours de courte durée) ne présentait pas de différences substantielles dans la capacité à refléter une amélioration (ou une aggravation) de l’évolution clinique du sepsis et du choc. septique et en réduisant l’exposition aux antibiotiques
Une thérapie individualisée consisterait à combiner une durée fixe avec un guidage par biomarqueurs, en utilisant une stratégie de « double déclenchement ». Après quelques jours de traitement, les antibiotiques pourraient être arrêtés en fonction de l’évolution clinique et de la diminution des niveaux de biomarqueurs (CRP ou PCT), selon un algorithme prédéfini, ou de l’achèvement de 5 à 7 jours complets de traitement par antibiotiques, selon la première éventualité ( Fig.2 ). Cette stratégie individualisée a été évaluée dans plusieurs ECR montrant que le guidage par biomarqueurs peut réduire en toute sécurité la durée du traitement par rapport à une durée fixe.
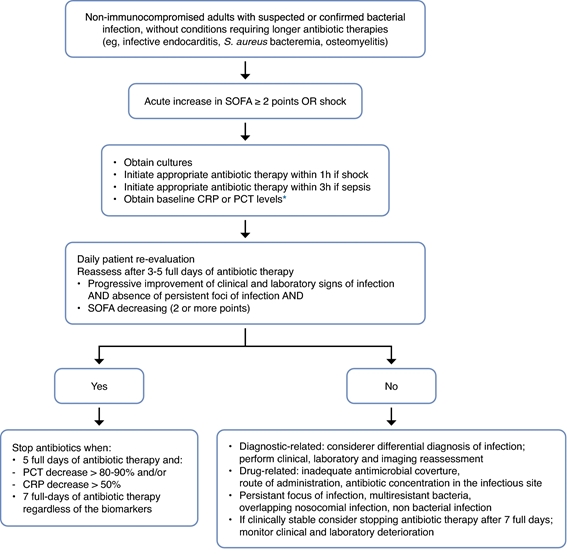
Figure 2. Guide de l’utilisateur pour l’antibiothérapie guidée par biomarqueurs. L’instauration d’un traitement antibiotique chez les patients gravement malades chez lesquels on soupçonne un sepsis doit être effectuée quel que soit le niveau de tout biomarqueur. Mais cela doit être réévalué quotidiennement. Utilisez l’évolution clinique, l’évolution du dysfonctionnement d’un organe (avec score SOFA), la cinétique des biomarqueurs et la durée du traitement antibiotique pour déterminer la durée optimale du traitement. Ces recommandations ne s’appliquent pas aux patients immunodéprimés ou aux patients présentant des infections nécessitant une antibiothérapie au long cours, comme une endocardite ou une ostéomyélite.
Perspectives d’avenir
La combinaison de plusieurs biomarqueurs pour construire un panel de diagnostic ne s’est pas révélée systématiquement supérieure à n’importe quel biomarqueur individuel dans le diagnostic du sepsis. Cela vient du fait que les biomarqueurs du sepsis sont souvent fortement corrélés et que, par conséquent, la précision du diagnostic ne s’est pas améliorée lorsque ces tests ont été combinés.
La précision diagnostique d’un panel de biomarqueurs dépend en outre de la manière dont les résultats des tests individuels sont pondérés et du nombre de tests qui doivent être positifs pour que le panel global indique la présence d’un sepsis. Par exemple, un panel de biomarqueurs peut être relativement sensible (exigeant qu’un seul test individuel soit « positif ») ou relativement spécifique (exigeant que tous les tests individuels soient positifs) selon la façon dont le panel est interprété.
Cependant, les algorithmes qui combinent des biomarqueurs avec des données cliniques se sont révélés prometteurs pour identifier les patients atteints de sepsis aux urgences. Un tel algorithme combinant des variables cliniques et un panel de biomarqueurs revendiquait une valeur prédictive négative de 100 % et une valeur prédictive positive de 93 % dans une cohorte de 158 patients.
Conclusions Passer d’où nous en sommes actuellement avec les biomarqueurs du sepsis à un point où nous disposons de marqueurs cliniquement utiles qui orientent les parcours de traitement des patients pour améliorer les résultats nécessitera un changement d’approche significatif. Il est peu probable que les études unidimensionnelles menées dans un seul centre apportent de grands progrès. Ce qu’il faut, ce sont de grandes études de cohortes multicentriques qui utilisent des algorithmes de pointe pour identifier des biomarqueurs qui prédisent des réponses différentielles aux interventions dans des endotypes cliniques spécifiques. La combinaison des outils existants dans des collaborations multicentriques et multidisciplinaires sera le moyen le plus efficace de découvrir de nouveaux biomarqueurs pouvant être mis en œuvre dans la pratique clinique pour optimiser les soins aux patients. D’ici là, les biomarqueurs du sepsis peuvent constituer des outils complémentaires utiles lorsque les cliniciens ont besoin d’informations supplémentaires pour optimiser les soins aux patients au chevet. Les déterminations en série sont plus informatives qu’une valeur unique et les biomarqueurs ne doivent jamais être utilisés comme test autonome, mais toujours en conjonction avec une évaluation clinique approfondie. |
















