Zusammenfassung Insulin hemmt die Gluconeogenese und stimuliert die Umwandlung von Glucose in Glykogen und Lipide. Es ist unklar, wie diese Aktivitäten koordiniert werden, um Hypoglykämie und Hepatosteatose zu verhindern. Fructose-1,6-Bisphosphatase (FBP1) steuert die Geschwindigkeit der Gluconeogenese. Ein angeborener Mangel an menschlichem FBP1 verursacht jedoch keine Hypoglykämie, es sei denn, er geht mit Fasten oder Hungern einher, die auch paradoxe Hepatomegalie, Hepatosteatose und Hyperlipidämie auslösen. Mäuse mit FBP1-Hepatozytenablation weisen identische durch Fasten bedingte Pathologien sowie eine Hyperaktivierung von AKT auf, deren Hemmung Hepatomegalie, Hepatosteatose und Hyperlipidämie, jedoch keine Hypoglykämie umkehrte. Überraschenderweise ist die durch Fasten vermittelte AKT-Hyperaktivierung insulinabhängig. Unabhängig von seiner katalytischen Aktivität verhindert FBP1 eine Überreaktion auf Insulin, indem es mit AKT, PP2A-C und Aldolase B (ALDOB) einen stabilen Komplex bildet, der gezielt die Dephosphorylierung von AKT beschleunigt. Die durch Fasten verstärkte und durch erhöhtes Insulin geschwächte Bildung des FBP1:PP2A-C:ALDOB:AKT-Komplexes, der durch menschliche FBP1-Mangelmutationen oder eine C-terminale FBP1-Verkürzung gestört wird, beugt durch Insulin verursachten Lebererkrankungen vor und sorgt für die Aufrechterhaltung von Lipid- und Lipidwerten Glukosehomöostase. Im Gegensatz dazu kehrt ein von FBP1 abgeleitetes komplexes Störpeptid die ernährungsbedingte Insulinresistenz um. |
Kommentare
Seit der Entdeckung des Insulins ist etwas mehr als ein Jahrhundert vergangen, eine Zeit, in der die therapeutischen Kräfte des Hormons erweitert und verfeinert wurden. Insulin ist eine wesentliche Behandlung für Typ-1-Diabetes und häufig auch für Typ-2-Diabetes. Laut der American Diabetes Association verwenden etwa 8,4 Millionen Amerikaner Insulin.
Hundert Jahre Forschung haben das medizinische und biochemische Verständnis darüber, wie Insulin wirkt und was passiert, wenn es fehlt, erheblich vorangebracht, aber das Gegenteil – wie eine potenziell tödliche Insulinüberreaktion verhindert wird – bleibt ein hartnäckiges Rätsel.
In einer neuen Studie, die in „Cell Metabolism“ veröffentlicht wurde, beschreibt ein Team von Wissenschaftlern der University of California, San Diego School of Medicine, zusammen mit Kollegen anderswo, einen Schlüsselakteur im Abwehrmechanismus, der uns vor einem Überschuss an Insulin im Körper schützt.
„Obwohl Insulin eines der wichtigsten Hormone ist, dessen Mangel zum Tod führen kann, kann zu viel Insulin auch tödlich sein“, sagte der leitende Autor der Studie, Michael Karin, PhD, angesehener Professor für Pharmakologie und Pathologie an der Fakultät der Medizin. von der UC San Diego.
„Während unser Körper die Insulinproduktion feinabstimmt, kommt es bei Patienten, die mit Insulin oder Medikamenten behandelt werden, die die Insulinsekretion anregen, häufig zu Hypoglykämie , einem Zustand, der, wenn er unerkannt und unbehandelt bleibt, zu Anfällen, Koma und sogar zum Tod führen kann Zustand namens Insulinschock.“
Hypoglykämie (niedriger Blutzucker) ist eine der häufigsten Todesursachen bei Menschen mit Diabetes .
In der neuen Studie beschreiben Karin, Erstautorin Li Gu, PhD, ein Postdoktorand in Karins Labor, und Kollegen „das natürliche Abwehr- oder Sicherheitsventil des Körpers “, das das Risiko eines Insulinschocks verringert.
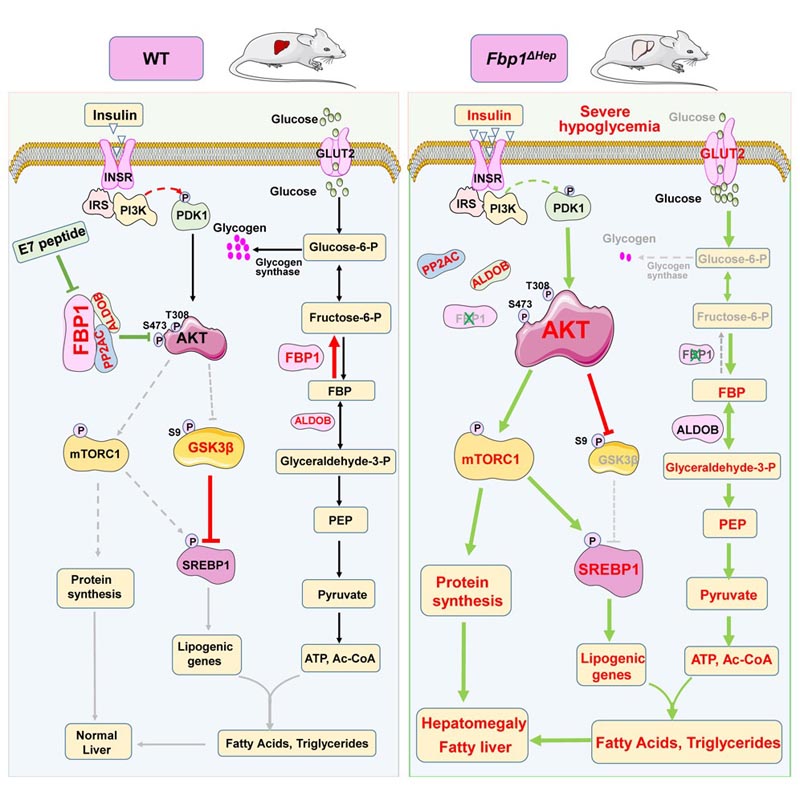
Bei dieser Klappe handelt es sich um ein Stoffwechselenzym namens Fruktose-1,6-Bisphosphatphosphatase oder FBP1 , das die Gluconeogenese steuert , einen Prozess, bei dem die Leber im Schlaf Glukose (die Hauptenergiequelle für Zellen und Gewebe) synthetisiert und an die Leber absondert Aufrechterhaltung einer konstanten Glukoseversorgung im Blutkreislauf.
Einige Antidiabetika wie Metformin hemmen die Gluconeogenese, jedoch ohne offensichtliche schädliche Wirkungen. Auch Kinder, die mit einer seltenen genetischen Störung geboren werden, bei der sie nicht genügend FBP1 produzieren, können gesund bleiben und ein langes Leben führen.
Aber in anderen Fällen, wenn dem Körper Glukose oder Kohlenhydrate fehlen, kann ein FBP1-Mangel zu schwerer Hypoglykämie führen . Ohne eine Glukoseinfusion kann es zu Krampfanfällen, Koma und möglicherweise zum Tod kommen.
Um das Problem noch zu verschärfen und zu verwirren, führt ein FPB1-Mangel in Kombination mit einem Glukosemangel zu Nebenwirkungen, die nichts mit der Glukoneogenese zu tun haben, wie z. B. einer vergrößerten Fettleber , leichten Leberschäden und erhöhten Lipid- oder Fettwerten im Blut.
Um die Funktionen von FBP1 besser zu verstehen, erstellten die Forscher ein Mausmodell mit leberspezifischem FBP1-Mangel, das den menschlichen Zustand genau nachahmt. Wie Kinder mit FBP1-Mangel wirkten die Mäuse bis zum Fasten normal und gesund, was schnell zu einer schweren Hypoglykämie sowie den oben beschriebenen Leberanomalien und Hyperlipidämie führte.
Gu und seine Kollegen entdeckten, dass FBP1 mehrere Funktionen hatte. FBP1 spielte nicht nur eine Rolle bei der Umwandlung von Fructose in Glucose, sondern hatte auch eine zweite nicht-enzymatische, aber entscheidende Funktion: Es hemmte die Proteinkinase AKT, die den Hauptweg für die Insulinaktivität darstellt.
„Grundsätzlich hält FBP1 die AKT in Schach und schützt vor Insulin-Hyperreaktivität, hypoglykämischem Schock und akuter Fettlebererkrankung“, sagte Erstautor Gu.
In Zusammenarbeit mit Yahui Zhu, einem Gastwissenschaftler an der Universität Chongqing in China und Zweitautor der Studie, entwickelte Gu ein von FBP1 abgeleitetes Peptid (eine Kette von Aminosäuren), das die Assoziation von FBP1 mit AKT und einem anderen Protein, das AKT inaktiviert, störte.
„Dieses Peptid wirkt als Insulin-Mimetikum und aktiviert AKT“, sagte Karin. „Wenn das Peptid (mit dem Spitznamen E7) Mäusen injiziert wird, die eine Insulinresistenz entwickelt haben, eine sehr häufige prädiabetische Erkrankung, die auf den längeren Verzehr einer fettreichen Ernährung zurückzuführen ist, kann es die Insulinresistenz umkehren und die Blutzuckerkontrolle wiederherstellen. normal.“
Karin sagte, Forscher würden E7 gerne als klinisch nützliche Alternative zu Insulin weiterentwickeln, „weil wir allen Grund zu der Annahme haben, dass es unwahrscheinlich ist, dass es einen Insulinschock verursacht.“