Résumé L’insuline inhibe la gluconéogenèse et stimule la conversion du glucose en glycogène et en lipides. On ne sait pas clairement comment ces activités sont coordonnées pour prévenir l’hypoglycémie et l’hépatostéatose. La fructose-1,6-bisphosphatase (FBP1) contrôle le taux de gluconéogenèse. Cependant, un déficit congénital en FBP1 humain ne provoque pas d’hypoglycémie à moins qu’il ne soit accompagné de jeûne ou de famine, qui déclenchent également une hépatomégalie paradoxale, une hépatostéatose et une hyperlipidémie. Les souris ayant subi une ablation d’hépatocytes FBP1 présentent des pathologies identiques conditionnées par le jeûne et une hyperactivation de l’AKT, dont l’inhibition a inversé l’hépatomégalie, l’hépatostéatose et l’hyperlipidémie, mais pas l’hypoglycémie. Étonnamment, l’hyperactivation de l’AKT médiée par le jeûne est insulino-dépendante. Indépendamment de son activité catalytique, FBP1 prévient l’hyperréactivité à l’insuline en formant un complexe stable avec l’AKT, la PP2A-C et l’aldolase B (ALDOB), qui accélère spécifiquement la déphosphorylation de l’AKT. Améliorée par le jeûne et affaiblie par une insuline élevée, la formation du complexe FBP1:PP2A-C:ALDOB:AKT, qui est perturbé par des mutations du déficit FBP1 humain ou une troncature C-terminale de FBP1, prévient les pathologies hépatiques causées par l’insuline et maintient les lipides et homéostasie du glucose. En revanche, un peptide perturbateur complexe dérivé de FBP1 inverse la résistance à l’insuline induite par l’alimentation. |
commentaires
Un peu plus d’un siècle s’est écoulé depuis la découverte de l’insuline, une période au cours de laquelle les pouvoirs thérapeutiques de l’hormone ont été élargis et affinés. L’insuline est un traitement essentiel pour le diabète de type 1 et souvent aussi pour le diabète de type 2. Environ 8,4 millions d’Américains utilisent de l’insuline, selon l’American Diabetes Association.
Cent ans de recherche ont considérablement fait progresser la compréhension médicale et biochimique du fonctionnement de l’insuline et de ce qui se passe en cas d’absence d’insuline, mais l’inverse – comment éviter une hyperréactivité insulinique potentiellement mortelle – reste un mystère persistant.
Dans une nouvelle étude publiée dans Cell Metabolism , une équipe de scientifiques de la faculté de médecine de l’Université de Californie à San Diego, ainsi que des collègues d’ailleurs, décrivent un acteur clé du mécanisme de défense qui nous protège contre l’excès d’insuline dans le corps.
"Bien que l’insuline soit l’une des hormones les plus essentielles, dont une insuffisance peut entraîner la mort, une trop grande quantité d’insuline peut également être fatale", a déclaré l’auteur principal de l’étude, Michael Karin, PhD, professeur émérite de pharmacologie et de pathologie à l’école. de Médecine. de l’Université de Californie à San Diego.
"Alors que notre corps ajuste la production d’insuline, les patients traités avec de l’insuline ou des médicaments qui stimulent la sécrétion d’insuline souffrent souvent d’hypoglycémie , une condition qui, si elle n’est pas reconnue et non traitée, peut entraîner des convulsions, le coma et même la mort, qui définissent collectivement un condition appelée choc insulinique.
L’hypoglycémie (faible taux de sucre dans le sang) est l’une des principales causes de décès chez les personnes atteintes de diabète .
Dans la nouvelle étude, Karin, le premier auteur Li Gu, PhD, chercheur postdoctoral dans le laboratoire de Karin, et ses collègues décrivent « la défense naturelle ou soupape de sécurité du corps » qui réduit le risque de choc insulinique.
Cette valve est une enzyme métabolique appelée fructose-1,6-bisphosphate phosphatase ou FBP1 , qui agit pour contrôler la gluconéogenèse , un processus dans lequel le foie synthétise le glucose (la principale source d’énergie utilisée par les cellules et les tissus) pendant le sommeil et le sécrète pour maintenir un apport constant de glucose dans le sang.
Certains médicaments antidiabétiques, comme la metformine, inhibent la gluconéogenèse mais sans effets nocifs apparents. Les enfants nés avec une maladie génétique rare dans laquelle ils ne produisent pas suffisamment de FBP1 peuvent également rester en bonne santé et vivre longtemps.
Mais dans d’autres cas, lorsque l’organisme manque de glucose ou de glucides, un déficit en FBP1 peut entraîner une hypoglycémie sévère . Sans perfusion de glucose, des convulsions, le coma et éventuellement la mort peuvent survenir.
Pour aggraver et confondre le problème, un déficit en FPB1 combiné à un manque de glucose produit des effets indésirables non liés à la gluconéogenèse, tels qu’une hypertrophie du foie , de légères lésions hépatiques et des taux élevés de lipides ou de graisses dans le sang.
Pour mieux comprendre les fonctions de FBP1, les chercheurs ont créé un modèle de souris présentant un déficit en FBP1 spécifique au foie, imitant précisément la condition humaine. Comme les enfants déficients en FBP1, les souris semblaient normales et en bonne santé jusqu’au jeûne, ce qui a rapidement entraîné une hypoglycémie sévère, des anomalies hépatiques et une hyperlipidémie décrites ci-dessus.
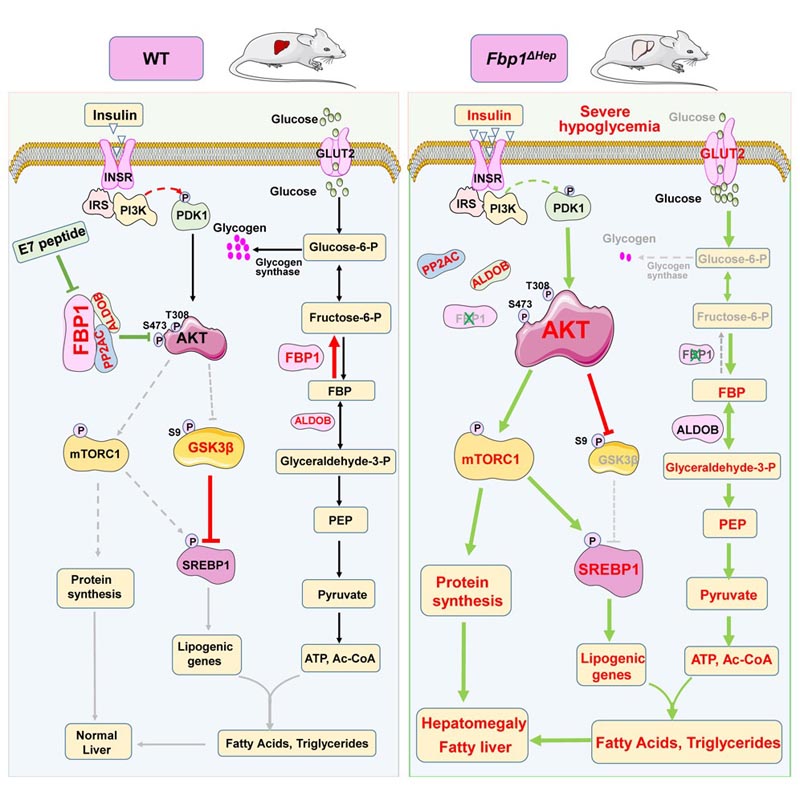
Gu et ses collègues ont découvert que FBP1 avait plusieurs fonctions. Au-delà de son rôle dans la conversion du fructose en glucose, FBP1 avait une deuxième fonction non enzymatique mais essentielle : elle inhibait la protéine kinase AKT, qui est la principale voie d’activité de l’insuline.
"Fondamentalement, FBP1 contrôle l’AKT et protège contre l’hyperréactivité à l’insuline, le choc hypoglycémique et la stéatose hépatique aiguë", a déclaré le premier auteur Gu.
En collaboration avec Yahui Zhu, chercheur invité à l’Université de Chongqing en Chine et deuxième auteur de l’étude, Gu a développé un peptide (une chaîne d’acides aminés) dérivé de FBP1 qui a perturbé l’association de FBP1 avec AKT et une autre protéine qui inactive l’AKT.
"Ce peptide agit comme un mimétique de l’insuline , activant l’AKT", a déclaré Karin. "Lorsqu’il est injecté à des souris devenues résistantes à l’insuline, une condition prédiabétique très courante, en raison d’une consommation prolongée d’un régime riche en graisses, le peptide (surnommé E7) peut inverser la résistance à l’insuline et restaurer le contrôle glycémique normal".
Karin a déclaré que les chercheurs aimeraient continuer à développer l’E7 comme alternative cliniquement utile à l’insuline "parce que nous avons toutes les raisons de croire qu’il est peu probable qu’il provoque un choc insulinique".