Retatrutid, dreifacher Hormonrezeptoragonist gegen Fettleibigkeit: eine Phase-2-Studie
Hintergrund
Retatrutid (LY3437943) ist ein Agonist des glukoseabhängigen insulinotropen Polypeptids, des Glucagon-ähnlichen Peptids 1 und der Glucagonrezeptoren. Seine Dosis-Wirkungs-Beziehungen hinsichtlich Nebenwirkungen, Sicherheit und Wirksamkeit bei der Behandlung von Fettleibigkeit sind unbekannt.
Methoden
Wir haben eine doppelblinde, randomisierte, placebokontrollierte Phase-2-Studie mit Erwachsenen durchgeführt, die einen Body-Mass-Index (BMI, Gewicht in Kilogramm geteilt durch das Quadrat der Körpergröße in Metern) von 30 oder mehr oder einen BMI von 27 bis hatten weniger als 30 plus mindestens eine gewichtsbedingte Erkrankung.
Die Teilnehmer wurden nach dem Zufallsprinzip im Verhältnis 2:1:1:1:1:2:2 einer subkutanen Gabe von Retatrutid (1 mg, 4 mg [Anfangsdosis 2 mg], 4 mg [Anfangsdosis 4 mg], 8 mg) zugeteilt [Anfangsdosis 2 mg], 8 mg [Anfangsdosis 4 mg] oder 12 mg [Anfangsdosis 2 mg]) oder Placebo einmal pro Woche für 48 Wochen.
Der primäre Endpunkt war die prozentuale Veränderung des Körpergewichts vom Ausgangswert bis zur 24. Woche. Zu den sekundären Endpunkten gehörten eine prozentuale Veränderung des Körpergewichts vom Ausgangswert bis zur 48. Woche und ein Gewichtsverlust von 5 % oder mehr, 10 % oder mehr oder 15 % oder mehr. Auch die Sicherheit wurde bewertet.
Ergebnisse
Wir haben 338 Erwachsene eingeschrieben , 51,8 % davon waren Männer. Die kleinste quadratische mittlere prozentuale Veränderung des Körpergewichts nach 24 Wochen betrug in den Retatrutid-Gruppen –7,2 % in der 1-mg-Gruppe, –12,9 % in der 4-mg-Kombinationsgruppe, –17,3 % in der 8-mg-Kombinationsgruppe und –17,5 % in der 12-mg-Gruppe, verglichen mit -1,6 % in der Placebo-Gruppe.
Nach 48 Wochen betrug die mittlere prozentuale Veränderung der kleinsten Quadrate in den Retatrutid-Gruppen -8,7 % in der 1-mg-Gruppe, -17,1 % in der 4-mg-Kombinationsgruppe, -22,8 % in der kombinierten 8-mg-Gruppe und -24,2 % in der 12 mg-Gruppe, verglichen mit −2,1 % in der Placebo-Gruppe.
Nach 48 Wochen war bei 92 %, 75 % bzw. 60 % der Teilnehmer, die 4 mg Retatrutid erhielten, ein Gewichtsverlust von 5 % oder mehr, 10 % oder mehr und 15 % oder mehr aufgetreten; 100 %, 91 % und 75 % derjenigen, die 8 mg erhielten; 100 %, 93 % und 83 % derjenigen, die 12 mg erhielten; und 27 %, 9 % und 2 % derjenigen, die ein Placebo erhielten.
Die häufigsten unerwünschten Ereignisse in den Retatrutid-Gruppen waren gastrointestinaler Natur; Diese Ereignisse waren dosisabhängig, meist von leichter bis mittelschwerer Schwere und wurden teilweise durch eine niedrigere Anfangsdosis (2 mg vs. 4 mg) gemildert. Der dosisabhängige Anstieg der Herzfrequenz erreichte seinen Höhepunkt nach 24 Wochen und nahm danach ab.
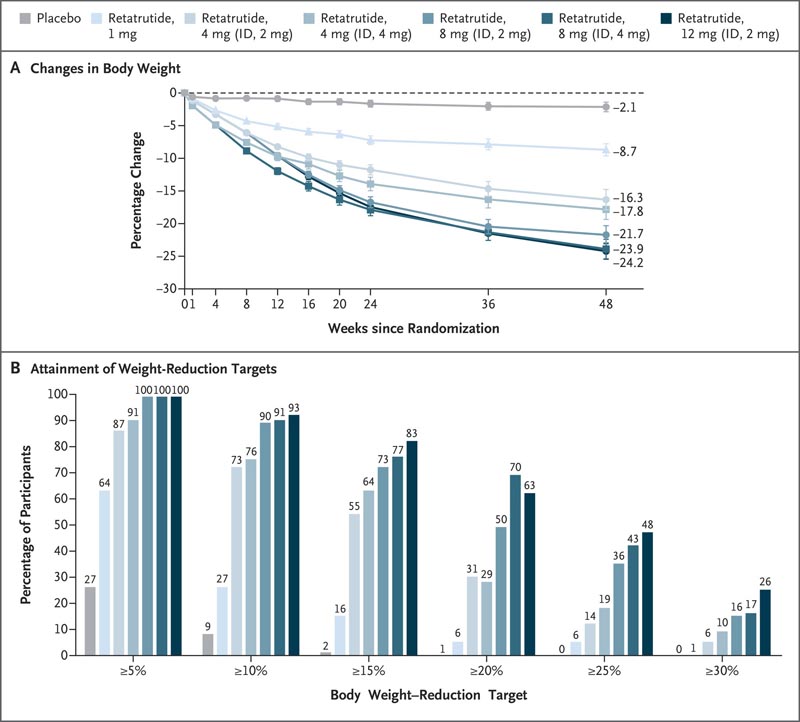
Abbildung: Veränderungen des Körpergewichts unter Retatrutid im Vergleich zu Placebo . Panel A zeigt die prozentuale Veränderung des Körpergewichts vom Ausgangswert bis zur 48. Woche, abgeleitet aus einer MMRM-Analyse (Mixed Model for Repeated Measures) zur Wirksamkeitsabschätzung. Die angezeigten Werte sind Mittelwerte der kleinsten Quadrate; Balken geben Standardfehler an. Panel B zeigt den Prozentsatz der Teilnehmer mit einer prozentualen Reduzierung des Körpergewichts um mindestens 5 %, 10 %, 15 %, 20 %, 25 % und 30 % vom Ausgangswert bis Woche 48. Die Wirksamkeitsendpunkte wurden mit Daten aller Teilnehmer analysiert, die wurden einer Randomisierung unterzogen, wobei diejenigen ausgeschlossen wurden, die die Behandlung aufgrund einer versehentlichen Aufnahme in die Studie abbrachen. ID gibt die Anfangsdosis an.
Schlussfolgerungen Bei Erwachsenen mit Adipositas führte die 48-wöchige Behandlung mit Retatrutid zu einer erheblichen Verringerung des Körpergewichts. |
Referenz : NEJM DOI: 10.1056/NEJMoa2301972
(Gefördert von Eli Lilly; ClinicalTrials.gov-Nummer, NCT04881760. Wird in neuem Tab geöffnet.)
















