Retatrutide, triplo agonista dei recettori ormonali per l’obesità: uno studio di fase 2
Sfondo
Retatrutide (LY3437943) è un agonista del polipeptide insulinotropico glucosio-dipendente, del peptide 1 simile al glucagone e dei recettori del glucagone. Le sue relazioni dose-risposta rispetto agli effetti collaterali, alla sicurezza e all’efficacia per il trattamento dell’obesità sono sconosciute.
Metodi
Abbiamo condotto uno studio di fase 2, in doppio cieco, randomizzato, controllato con placebo in adulti che avevano un indice di massa corporea (BMI, peso in chilogrammi diviso per il quadrato dell’altezza in metri) pari o superiore a 30 o che avevano un BMI da 27 a meno di 30 più almeno una condizione correlata al peso.
I partecipanti sono stati assegnati in modo casuale in un rapporto 2:1:1:1:1:2:2 a ricevere retatrutide per via sottocutanea (1 mg, 4 mg [dose iniziale, 2 mg], 4 mg [dose iniziale, 4 mg], 8 mg [dose iniziale, 2 mg], 8 mg [dose iniziale, 4 mg] o 12 mg [dose iniziale, 2 mg]) o placebo una volta alla settimana per 48 settimane.
L’ endpoint primario era la variazione percentuale del peso corporeo dal basale a 24 settimane. Gli endpoint secondari includevano la variazione percentuale del peso corporeo dal basale a 48 settimane e una perdita di peso pari o superiore al 5%, pari o superiore al 10% o pari o superiore al 15%. È stata valutata anche la sicurezza.
Risultati
Abbiamo arruolato 338 adulti , il 51,8% dei quali erano uomini. La variazione percentuale media dei minimi quadrati del peso corporeo a 24 settimane nei gruppi retatrutide è stata di -7,2% nel gruppo da 1 mg, -12,9% nel gruppo in combinazione da 4 mg, -17,3% nel gruppo in combinazione da 8 mg e -17,5% nel gruppo da 12 mg, rispetto al -1,6% nel gruppo placebo.
A 48 settimane , la variazione percentuale della media dei minimi quadrati nei gruppi retatrutide è stata di -8,7% nel gruppo 1 mg, -17,1% nel gruppo combinato 4 mg, -22,8% nel gruppo combinato 8 mg e -24,2% nel gruppo 12 gruppo mg, rispetto al -2,1% nel gruppo placebo.
A 48 settimane, una perdita di peso del 5% o più, del 10% o più e del 15% o più si era verificata rispettivamente nel 92%, 75% e 60% dei partecipanti che avevano ricevuto 4 mg di retatrutide; 100%, 91% e 75% di coloro che hanno ricevuto 8 mg; 100%, 93% e 83% di coloro che hanno ricevuto 12 mg; e il 27%, 9% e 2% di coloro che hanno ricevuto il placebo.
Gli eventi avversi più comuni nei gruppi retatrutide sono stati gastrointestinali; questi eventi erano correlati alla dose, erano per lo più di gravità da lieve a moderata e sono stati parzialmente mitigati da una dose iniziale più bassa (2 mg rispetto a 4 mg). Gli aumenti dose-dipendenti della frequenza cardiaca hanno raggiunto il picco alla 24a settimana e successivamente sono diminuiti.
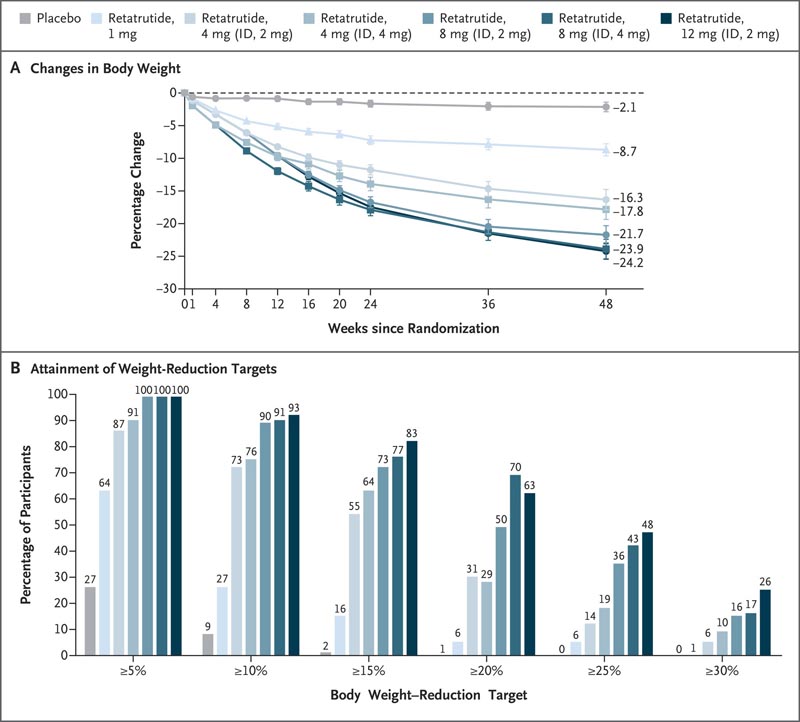
Figura: variazioni del peso corporeo con retatrutide rispetto al placebo . Il pannello A mostra la variazione percentuale del peso corporeo dal basale alla settimana 48, derivata da un’analisi del modello misto per misure ripetute (MMRM) per la stima dell’efficacia. I valori indicati sono medie dei minimi quadrati; Le barre indicano errori standard. Il pannello B mostra le percentuali di partecipanti con riduzioni percentuali del peso corporeo di almeno il 5%, 10%, 15%, 20%, 25% e 30% dal basale alla settimana 48. Gli endpoint di efficacia sono stati analizzati con i dati di tutti i partecipanti che sono stati sottoposti a randomizzazione, escludendo coloro che hanno interrotto il trattamento a causa di arruolamento involontario. L’ID indica la dose iniziale.
Conclusioni Negli adulti obesi, il trattamento con retatrutide per 48 settimane ha prodotto riduzioni sostanziali del peso corporeo. |
Riferimento : NEJM DOI: 10.1056/NEJMoa2301972
(Finanziato da Eli Lilly; numero ClinicalTrials.gov, NCT04881760. si apre in una nuova scheda.)
















