Retatrutide, agoniste des triples récepteurs hormonaux de l’obésité : un essai de phase 2
Arrière-plan
Le rétatrutide (LY3437943) est un agoniste du polypeptide insulinotrope glucose-dépendant, du peptide de type glucagon 1 et des récepteurs du glucagon. Ses relations dose-réponse en ce qui concerne les effets secondaires, la sécurité et l’efficacité du traitement de l’obésité sont inconnues.
Méthodes
Nous avons mené un essai de phase 2, en double aveugle, randomisé et contrôlé par placebo chez des adultes ayant un indice de masse corporelle (IMC, poids en kilogrammes divisé par le carré de la taille en mètres) de 30 ou plus ou ayant un IMC de 27 à 30. moins de 30 plus au moins une condition liée au poids.
Les participants ont été répartis au hasard selon un rapport 2:1:1:1:1:2:2 pour recevoir du rétatrutide sous-cutané (1 mg, 4 mg [dose initiale, 2 mg], 4 mg [dose initiale, 4 mg], 8 mg [dose initiale, 2 mg], 8 mg [dose initiale, 4 mg] ou 12 mg [dose initiale, 2 mg]) ou un placebo une fois par semaine pendant 48 semaines.
Le critère d’évaluation principal était le pourcentage de variation du poids corporel entre le départ et 24 semaines. Les critères d’évaluation secondaires comprenaient le pourcentage de variation du poids corporel entre le départ et 48 semaines et une perte de poids de 5 % ou plus, 10 % ou plus, ou 15 % ou plus. La sécurité a également été évaluée.
Résultats
Nous avons inscrit 338 adultes , dont 51,8 % d’hommes. Le pourcentage moyen de variation du poids corporel à 24 semaines dans les groupes retatrutide était de −7,2 % dans le groupe 1 mg, de −12,9 % dans le groupe 4 mg combinés, de −17,3 % dans le groupe combiné 8 mg et de -17,5 %. dans le groupe 12 mg, contre -1,6 % dans le groupe placebo.
À 48 semaines , la variation moyenne en pourcentage dans les groupes retatrutide était de -8,7 % dans le groupe 1 mg, de -17,1 % dans le groupe 4 mg combinés, de -22,8 % dans le groupe combiné 8 mg et de -24,2 % dans le groupe 12 mg. mg, contre −2,1 % dans le groupe placebo.
À 48 semaines, une perte de poids de 5 % ou plus, 10 % ou plus et 15 % ou plus s’est produite chez 92 %, 75 % et 60 %, respectivement, des participants recevant 4 mg de rétatrutide ; 100 %, 91 % et 75 % de ceux qui ont reçu 8 mg ; 100 %, 93 % et 83 % de ceux qui ont reçu 12 mg ; et 27 %, 9 % et 2 % de ceux qui ont reçu un placebo.
Les événements indésirables les plus fréquents dans les groupes retatrutide étaient gastro-intestinaux ; ces événements étaient liés à la dose, étaient pour la plupart de gravité légère à modérée et ont été partiellement atténués par une dose initiale plus faible (2 mg contre 4 mg). Les augmentations de la fréquence cardiaque dépendantes de la dose ont culminé à 24 semaines et ont diminué par la suite.
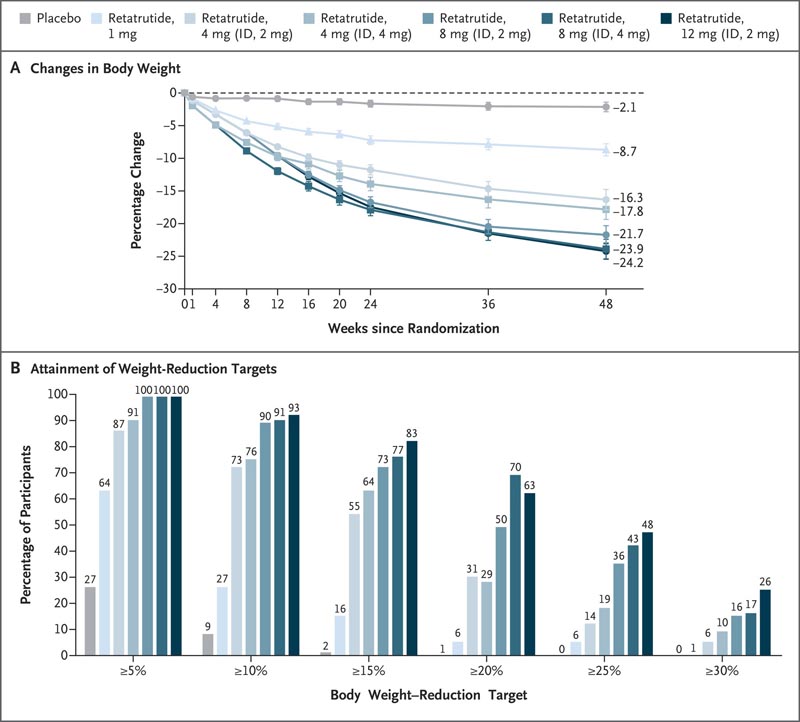
Figure : Modifications du poids corporel avec le rétatrutide par rapport au placebo . Le panneau A montre la variation en pourcentage du poids corporel entre la ligne de base et la semaine 48, dérivée d’une analyse de modèle mixte pour mesures répétées (MMRM) pour l’estimation de l’efficacité. Les valeurs affichées sont les moyennes des moindres carrés ; Les barres indiquent les erreurs standard. Le panneau B montre les pourcentages de participants présentant des réductions de poids corporel d’au moins 5 %, 10 %, 15 %, 20 %, 25 % et 30 % entre le départ et la semaine 48. Les paramètres d’efficacité ont été analysés avec les données de tous les participants qui ont subi une randomisation, excluant ceux qui ont interrompu le traitement en raison d’une inscription par inadvertance. ID indique la dose initiale.
Conclusions Chez les adultes obèses, un traitement par rétatrutide pendant 48 semaines a entraîné une réduction substantielle du poids corporel. |
Référence : NEJM DOI: 10.1056/NEJMoa2301972
(Financé par Eli Lilly ; numéro ClinicalTrials.gov, NCT04881760. s’ouvre dans un nouvel onglet.)
















