| Höhepunkte |
• Das Spektrum der klinischen Auswirkungen des vorzeitigen Ventrikelkomplexes (PVC) ist breit und reicht von der völligen Unbedenklichkeit bis hin zur Entwicklung einer Kardiomyopathie und Herzinsuffizienz und kann mit einem erhöhten Risiko eines plötzlichen Todes verbunden sein. • PVCs können sowohl Ursache als auch Folge einer nicht diagnostizierten Kardiomyopathie und des Fortschreitens einer Herzinsuffizienz sein. • Bei Patienten mit einer hohen PVC-Belastung (>10 %) sind Elektrokardiogramm, Ultraschall, Holter-Überwachung und Echokardiographie von entscheidender Bedeutung für die Beurteilung von Merkmalen, die bei zukünftigen Managemententscheidungen hilfreich sein können. • Die Behandlung symptomatischer PVCs, Hochrisiko-PVCs durch plötzlichen Herztod oder einer hohen Belastung durch PVCs, die eine Kardiomyopathie verursachen, umfasst medikamentöse Therapie und Katheterablation. |
| Einführung |
Vorzeitige ventrikuläre Komplexe (PVCs) werden durch eine frühe elektrische Aktivierung aus einer Fokusregion des Ventrikels definiert, die zu einer ventrikulären Kontraktion führt, bevor diese Kammern koordiniert und ausreichend gefüllt werden.
Die klinische Bedeutung von PVC reicht von völlig harmlos bis lebensbedrohlich.
Ein erheblicher Anteil der Patienten weist PVCs auf, die praktisch keine klinische Bedeutung haben; Es gibt jedoch eine beträchtliche Anzahl von Patienten, bei denen PVCs eine zugrunde liegende Kardiomyopathie oder eine Neigung zur Entwicklung einer Herzinsuffizienz darstellen können. Einige PVCs können auch das Risiko für ventrikuläre Arrhythmien, Synkopen und plötzlichen Herztod erhöhen.
Zu den Risikofaktoren zählen höheres Alter, männliches Geschlecht, Rauchen und Fettleibigkeit. Aufgrund ihrer Häufigkeit in der klinischen Praxis ist es zwingend erforderlich, dass der Hausarzt über Kenntnisse über den pathophysiologischen Mechanismus, die erforderlichen Studien und die Behandlung von PVCs verfügt. Darüber hinaus muss der Hausarzt in der Lage sein, gutartige von bösartigen PVCs zu unterscheiden und zu wissen, wann er einen Experten konsultieren muss.
| Pathophysiologie |
Zur Erklärung der PVC-Erzeugung werden drei Hauptmechanismen herangezogen: ausgelöste Aktivität, verstärkte Automatik und Wiedereintritt.
Die ausgelöste Aktivität wird durch einen Anstieg der intrazellulären Calciumkonzentration vermittelt, was zu verzögerten Nachdepolarisationen oder einer abnormalen Depolarisation von Herzmuskelzellen nach normaler Depolarisation führt.
Eine verstärkte Automatizität tritt auf, wenn bestimmte Myokardgewebe eine verstärkte oder übertriebene automatische Erzeugung kardialer elektrischer Impulse zeigen. Der Wiedereintrittsmechanismus erfordert zwei separate und unterschiedliche elektrische Leitungen mit unterschiedlicher Leitung an jedem Ende. Bereiche mit Narbenbildung und Fibrose (z. B. infolge koronarer Herzkrankheit oder Kardiomyopathien) können dazu führen, dass PVCs über einen Wiedereintrittsmechanismus verfügen ( Abbildung 1 ).
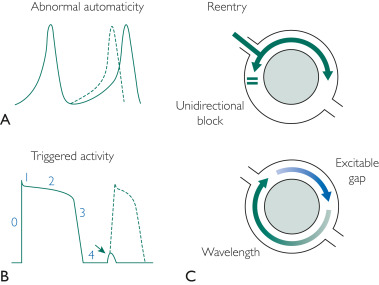
ABBILDUNG 1 . Drei Mechanismen der vorzeitigen Arrhythmogenese des Ventrikelkomplexes. A, abnormale Automatik: Beachten Sie den frühen Beginn des Aktionspotentials (gepunktete Linie). B, Ausgelöste Aktivität: Beachten Sie die Verzögerung der Nachdepolarisation, die in Phase 4 des Herzaktionspotentials auftritt. Wenn dieser Schwellenwert erreicht wird, kann es zu einer vollständigen Depolarisation kommen (gepunktete Linie). Dies ist nur ein Beispiel für den ausgelösten Aktivitätsmechanismus. C, Reentry: Leitungsbarriere (grauer Kreis, stellt Fibrose oder funktionelle Barriere dar) mit unidirektionaler Blockade, die eine Reentry-Arrhythmie erzeugt.
| Elektrisches Timing und damit verbundene hämodynamische Veränderungen |
Eine PVC stört die normale Füllung der Ventrikel. Zusätzlich dazu, dass der QRS-Komplex (der die ventrikuläre Kontraktion darstellt) früher als erwartet auftritt, weisen PVCs im EKG im Allgemeinen ein breiteres QRS-Erscheinungsbild (längere Dauer) auf als ein typischer QRS-Komplex im Sinusrhythmus ( Abbildung 2 ).
Vorzeitige ventrikuläre Komplexe entstehen durch fokale elektrische Impulse, die von verschiedenen Stellen in den Ventrikeln ausgehen. Im Gegensatz zu einem normalen Rhythmus nutzt die elektrische Erregungsleitung bei einem CVP im Allgemeinen nicht das spezielle Erregungsleitungssystem.
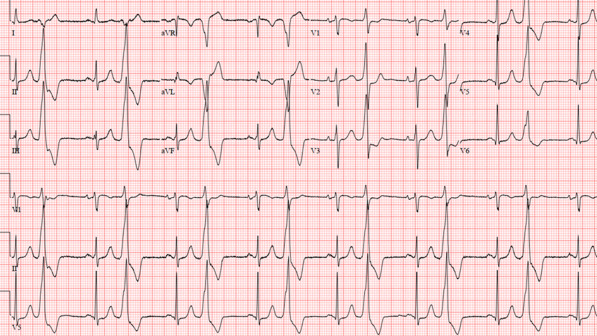
ABBILDUNG 2. Vorzeitige ventrikuläre Komplexe mit Bigeminusmuster. Beachten Sie die breiten komplexen Schläge, die bei jedem zweiten Sinusschlag auftreten (schmaler QRS, dem die P-Welle vorausgeht). Diese vorzeitigen ventrikulären Kontraktionen haben eine markante untere Achse (positiv II, III und aVF und negativ aVR und aVL), was wahrscheinlich auf einen Ursprung im Ausflusstrakt hinweist.
Da die diastolische Füllung des Ventrikels gestört ist, kommt es zu einer verminderten Füllung des Ventrikels. Dadurch verringert sich die Herzleistung aufgrund der PVC-bedingten ventrikulären Kontraktion. Es kann dazu führen, dass Patienten eine Vielzahl von Symptomen verspüren, darunter Kurzatmigkeit, Benommenheit und Müdigkeit. Darüber hinaus kann der Druck im linken Vorhof erheblich erhöht sein, was aufgrund des höheren Lungendrucks zu Dyspnoe führen kann.
| Klinische Bewertung und Naturgeschichte von CVP |
Das klinische Erscheinungsbild von PVCs kann unterschiedlich sein. Die meisten, insbesondere diejenigen mit geringer Belastung, sind bei bis zu 50 bis 75 % der Patienten asymptomatisch. Bei denjenigen, bei denen Symptome auftreten, sind die häufigsten Manifestationen Extrasystolen, Herzklopfen und ausgeprägter Herzschlag mit pochendem Gefühl.
Bei häufigeren und hämodynamisch signifikanten PVCs können Patienten über Müdigkeit, Schwindel, Präsynkope und Symptome einer Herzinsuffizienz wie Dyspnoe, Orthopnoe und Ödeme klagen.
Im Extremfall kann es bei Patienten mit elektrophysiologisch signifikanten PVCs zu Synkopen und plötzlichem Herzstillstand kommen.
In diesem Zusammenhang muss eine sorgfältige Anamnese erhoben werden, um die Ursachen einer Synkope abzugrenzen. Eine vasovagale (Reflex-)Synkope, die auf einen harmloseren klinischen Verlauf hinweist, geht in der Regel mit einem auslösenden Faktor oder Ereignis (z. B. Dehydrierung) und vorangehenden Symptomen (z. B. Übelkeit, Schwitzen) einher. Kardiogene oder arrhythmogene Synkopen treten plötzlich und ohne Vorwarnung auf und können mit Anstrengung verbunden sein.
Die Familienanamnese sollte ein Screening auf Herzinsuffizienz, koronare Herzkrankheit, Herzrhythmusstörungen, Kardiomyopathie in der Vorgeschichte und plötzliche, ungeklärte Todesfälle umfassen, insbesondere bei jungen Familienmitgliedern. Die Sozialgeschichte sollte eine detaillierte Beschreibung von Koffeinkonsum, Alkoholkonsum, Nahrungsergänzungsmitteln, Drogenkonsum und psychischen Stressfaktoren enthalten. Auch Aktivitäten wie Bewegung und Sportbeteiligung sollten evaluiert werden.
Zu den Medikamenten, die CVP auslösen können, gehören Beta-Agonisten (z. B. Albuterol-Inhalatoren bei Asthma oder chronisch obstruktiver Lungenerkrankung), Alkohol, Koffein und Stimulanzien, z. B. aus Amphetaminen. Eine Herzauskultation ist unerlässlich. Klinische Anzeichen einer Herzinsuffizienz sollten untersucht und bewertet werden.
Überwacht werden die Krankengeschichte des Patienten, die PVC-Morphologie (die die Lokalisierung seines Ursprungs im Herzen ermöglicht), PVC-Kopplungsintervalle (die Dauer zwischen dem Ende des vorherigen QRS und dem Beginn des PVC) und die Blutdruckbelastung. Ein CVP über 24 Stunden ist für die Bestimmung einer angemessenen Behandlung unerlässlich.
Bei manchen Patienten kann es zu einer geringen CVP-Belastung kommen, die jedoch schwerwiegende Folgen haben kann (z. B. plötzlicher Herztod), wenn das Kopplungsintervall weniger als 300 Millisekunden beträgt. Daher muss stets ein hohes Maß an Überwachung erfolgen, um eine ordnungsgemäße Bewertung sicherzustellen ( Abbildung 3 ).
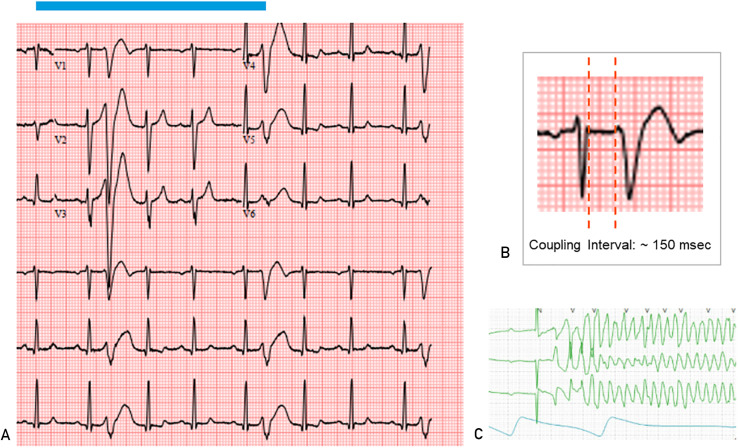
FIGUR 3 . A: Elektrokardiogramm, das einen kurz gekoppelten vorzeitigen ventrikulären Komplex (CVP) zeigt. Beachten Sie, dass diese kurzgekoppelten PVCs auf der T-Welle des vorangegangenen Sinusschlags liegen. B: Die Messung des PVC-Kopplungsintervalls sollte am Ende des vorderen QRS und am Beginn des PVC erfolgen. C: Telemetriestreifen, der eine polymorphe ventrikuläre Tachykardie zeigt, die durch eine eng gekoppelte PVC beim selben Patienten ausgelöst wird.
Insbesondere sollte sich der Internist auf die folgenden Merkmale konzentrieren, um einen Kardiologen aufzusuchen: PVC-Symptome, Verdacht auf Herzsynkope, plötzlicher Herztod in der Familienanamnese, PVC-Belastung von mehr als 10 % und kurzzeitige PVC (Kopplungsintervall < 300 Millisekunden). ).
| Maßgeschneiderte diagnostische Teststrategie für CVP |
Im hausärztlichen Bereich sollte die Tiefe der diagnostischen Abklärung sorgfältig auf den klinischen Verdacht abgestimmt werden, nachdem die Anamnese erhoben und die körperliche Untersuchung durchgeführt wurde. Bei fast allen gesunden, asymptomatischen Patienten ohne bekannte oder vermutete Herzerkrankung ist das initiale EKG sinnvoll. Wenn Symptome vorhanden sind oder eine Untersuchung oder ein Elektrokardiogramm Bedenken hinsichtlich einer erhöhten CVP-Belastung (>1 von 10 Schlägen) erkennen lässt, sollte eine Holter-Überwachung für eine 24-Stunden-Bewertung durchgeführt werden.
> Elektrokardiographie und Holter-Überwachung
Bei der EKG- und Holter-Überwachung sollte der Arzt Folgendes berücksichtigen: PVC-Belastung (normalerweise als Prozentsatz über einen bestimmten Zeitraum dargestellt); Morphologie und Achse des PVC, um die Lokalisierung des Ursprungsortes zu erleichtern; CVP-Kopplungsintervall; und, was am wichtigsten ist, wenn der Patient Symptome zeigt, Korrelation der PVCs genau zum Zeitpunkt der Symptome.
> Transthorakale Echokardiographie
Eine transthorakale Echokardiographie sollte bei Patienten mit einer PVC-Belastung von mehr als 5 % oder bei klinischer Indikation aufgrund der Anamnese und körperlichen Untersuchung in Betracht gezogen werden. Ärzte sollten insbesondere auf eine verminderte systolische Funktion des linken Ventrikels (linksventrikuläre Ejektionsfraktion < 50 %) oder auf Anzeichen einer links- oder rechtsventrikulären Vergrößerung und Dysfunktion achten, insbesondere wenn diese größer als mild sind.
Auch an eine Klappenerkrankung wie einen Mitralklappenprolaps oder eine Mitralanulusdisjunktion sollte gedacht werden. Herzstrukturelle Anomalien können auf ein zusätzliches arrhythmisches oder kardiomyopathisches Risiko für PVCs mit Ursprung in dieser Region hinweisen und sollten daher, falls vorhanden, an einen Kardiologen überwiesen werden.
> Zusätzliche Tests
Zusätzliche Tests sollten sich nach Erhalt der Studie an der Anamnese und dem klinischen Verdacht orientieren. Laboruntersuchungen sollten mindestens die Beurteilung der Serumelektrolytwerte , insbesondere von Kalium und Magnesium, umfassen. Im Allgemeinen sollte die Kaliumkonzentration im Serum über 4,0 mÄq/L und die Magnesiumkonzentration im Serum über 2,0 mÄq/L gehalten werden.
Das Schilddrüsen-stimulierende Hormon sollte überwacht werden, um eine Schilddrüsenerkrankung als sekundäre Ursache für PVC auszuschließen.
Das natriuretische Peptid des Gehirns kann als möglicher serologischer Marker für Herzstrukturanomalien getestet werden.
Bei klinischer Indikation können Stresstests mit und ohne zusätzliche Herzbildgebung (z. B. Stressechokardiographie oder Kernperfusionsstresstest) zum Ausschluss einer ischämischen Herzerkrankung in Betracht gezogen werden.
Fortgeschrittene kardiale Bildgebung, wie z. B. kardiale MRT zur Beurteilung verschiedener Kardiomyopathien und kardiale Positronenemissionstomographie zur Beurteilung aktiver Entzündungen, wie z. B. Herzsarkoidose, sollten im Allgemeinen unter Anleitung von Kardiologen durchgeführt werden. Diese Tests werden im Allgemeinen nicht routinemäßig ohne eine kardiologische Überweisung durchgeführt.
| Therapien für CVP |
Die meisten Patienten mit PVC, insbesondere mit geringer Belastung, sind asymptomatisch und erfordern keine zusätzlichen Studien, Therapie oder Nachsorge.
Der Hausarzt sollte mit den Grundprinzipien des PVC-Managements vertraut sein, einschließlich des Zeitpunkts der Einleitung der Behandlung, angemessener Nachuntersuchungen und des Zeitpunkts der Überweisung zur kardiologischen Beratung.
> Nicht-pharmakologische Beratung und Management
Es ist wichtig, die Patienten zu fragen, wie störend ihre Symptome sind und ob sie nach der Beruhigung angesichts der potenziellen Risiken und Nebenwirkungen bei einem ansonsten harmlosen Zustand überhaupt eine medizinische Therapie oder eine Katheterablationstherapie versuchen möchten. Auch wenn es keine definitiven Studien gibt, die PVCs mit diesen Lebensgewohnheiten in Verbindung bringen, ist eine Mäßigung des Koffein- und Alkoholkonsums sowie die Raucherentwöhnung ein vernünftiger Rat.
Generell empfehlen die Autoren allen Patienten, sich an 5 Tagen in der Woche mindestens 30 Minuten am Tag zu bewegen. Patienten machen sich darüber oft Sorgen und sollten sich darüber im Klaren sein, dass körperliche Betätigung sicher ist. Wenn sich die Symptome durch sportliche Betätigung deutlich verschlimmern, sollten zusätzliche Studien, wie z. B. Stresstests, in Betracht gezogen werden.
> Medizinische Therapie
Die Hauptstützen der pharmakologischen Behandlung sind Betablocker und Nicht-Dihydropyridin-Kalziumkanalblocker (Diltiazem oder Verapamil). Bemerkenswert ist, dass einige Patienten diese Medikamente aufgrund von Nebenwirkungen wie Müdigkeit, Depression und erektiler Dysfunktion nicht vertragen. Bei solchen Patienten sollte bei häufiger PVC, Symptomen, die mit PVC, PVC-induzierter Herzinsuffizienz oder Arrhythmien korrelieren, eine frühzeitige Überweisung an einen Herzelektrophysiologen angestrebt werden, um eine Katheterablation in Betracht zu ziehen.
Betablocker und Nicht-Dihydropyridin-Kalziumkanalblocker sind pharmakologische Behandlungen der ersten Wahl. Beide Medikamente wurden in randomisierten kontrollierten Studien mit einer klinisch signifikanten Verringerung der PVC-Belastung bei etwa 12 % bis 24 % der Patienten in Verbindung gebracht, was auf die etwas begrenzte Wirksamkeit der medikamentösen Behandlung hinweist.
Wenn Betablocker und Kalziumkanalblocker unwirksam sind, können andere Antiarrhythmika in Betracht gezogen werden, wenn der Patient bei der Katheterablation zögert. Sotalol (Antiarrhythmikum der Klasse III), Flecainid ( Antiarrhythmikum der Klasse Ic) und Propafenon (Antiarrhythmikum der Klasse Ic) können gut verträglich und wirksam sein. Amiodaron ist ein sehr wirksames Medikament, kann jedoch langfristige Nebenwirkungen hervorrufen, die seine Anwendung bei jüngeren Patienten einschränken .
> Katheterablation
Die Katheterablation ist eine invasive, aber wirksame Methode zur Behandlung von PVCs mit verfahrenstechnischen Erfolgsraten von 80 % bis 95 %. In den jüngsten Konsensaussagen der Experten können Medikamente und Katheterablation als Erstlinientherapien angesehen werden. Daher kann die Entscheidung, eine Katheterablation direkt durchzuführen, mit Patienten besprochen werden, die bei der Einnahme von Langzeitmedikamenten zögern oder aufgrund von Nebenwirkungen und Unverträglichkeiten zuvor nicht auf Medikamente angesprochen haben.
| Zukünftige Richtungen |
In naher Zukunft ist mit einer Verbesserung der PVC-Erkennung mithilfe tragbarer Geräte zu rechnen.
Derzeit gilt als allgemeine Regel, dass der Arzt die Rhythmusstreifen immer manuell auf vom Gerät erkannte Arrhythmien untersuchen sollte, um eine Überdiagnose von Artefakten zu vermeiden, die häufig mit der Plethysmographie einhergehen.
Technologie sollte immer eine Ergänzung und kein Ersatz für die klinische Beurteilung bleiben.
| Abschluss |
Da immer mehr Patienten mit PVC diagnostiziert werden, ist es wichtig, dass der Hausarzt mit den Grundlagen der Diagnose und Behandlung vertraut ist. PVCs kommen in der Allgemeinbevölkerung sehr häufig vor und die meisten erfordern keine zusätzlichen Studien oder Behandlungen, wodurch unnötige weitere Tests vermieden werden.
Ärzte sollten auch auf symptomatische PVCs oder Hochrisikomerkmale achten, einschließlich einer PVC-Belastung von mehr als 10 %, plötzlichem Tod in der Familienanamnese, kardiogener Synkope, kurz gekoppelten PVCs (Kopplungsintervall < 300 Millisekunden) sowie Anzeichen und Symptome einer Herzerkrankung Versagen.
Es kann versucht werden, eine pharmakologische Behandlung mit Betablockern oder Kalziumkanalblockern durchzuführen, und die Überweisung an einen Kardiologen oder Herzelektrophysiologen ist gerechtfertigt, um eine Behandlung mit Antiarrhythmika oder eine Katheterablation einzuleiten.
















