| Points forts |
• Le spectre des implications cliniques du complexe ventriculaire prématuré (PVC) est large, allant du caractère totalement bénin au développement d’une cardiomyopathie et d’une insuffisance cardiaque, et peut être associé à un risque accru de mort subite. • Les ESV peuvent être à la fois une cause et une conséquence d’une cardiomyopathie non diagnostiquée et de la progression d’une insuffisance cardiaque congestive. • Chez les patients présentant une charge élevée de PVC (> 10 %), l’électrocardiogramme, l’échographie, la surveillance Holter et l’échocardiographie sont essentiels pour évaluer les caractéristiques qui aident à orienter les décisions de prise en charge futures. • La prise en charge des ESV symptomatiques, des ESV à haut risque dues à une mort cardiaque subite ou d’un nombre élevé d’ESV provoquant une cardiomyopathie comprend un traitement médical et une ablation par cathéter. |
Les complexes ventriculaires prématurés (PVC) sont définis par une activation électrique précoce à partir d’une région focale du ventricule, conduisant à une contraction ventriculaire avant la coordination et un remplissage adéquat de ces chambres.
La signification clinique des PVC va de complètement bénigne à potentiellement mortelle.
Une proportion significative de patients présentent des PVC pratiquement sans signification clinique ; Cependant, il existe un nombre considérable de patients chez lesquels les PVC peuvent représenter une cardiomyopathie sous-jacente ou une propension au développement d’une insuffisance cardiaque. Certains PVC peuvent également augmenter le risque d’arythmies ventriculaires, de syncope et de mort cardiaque subite.
Les facteurs de risque comprennent l’âge avancé, le sexe masculin, le tabagisme et l’obésité. Compte tenu de sa fréquence en pratique clinique, il est impératif que le médecin traitant connaisse le mécanisme physiopathologique, les études nécessaires et le traitement des PVC. De plus, le médecin généraliste doit être capable de distinguer les ESV bénignes des ESV malignes et savoir quand consulter un expert.
| Physiopathologie |
Trois mécanismes principaux sont utilisés pour expliquer la génération de PVC : l’activité déclenchée, l’automaticité améliorée et la réentrée.
L’activité déclenchée est médiée par une augmentation de la concentration intracellulaire de calcium, entraînant des post-dépolarisations retardées ou une dépolarisation anormale des myocytes cardiaques après une dépolarisation normale.
Une automaticité améliorée se produit lorsque certains tissus myocardiques présentent une génération automatique améliorée ou exagérée d’impulsions électriques cardiaques. La réentrée en tant que mécanisme nécessite 2 voies électriques séparées et distinctes avec une conduction différentielle à chaque extrémité. Les régions cicatricielles et fibrosées (par exemple, résultant d’une maladie coronarienne, de cardiomyopathies) peuvent provoquer un mécanisme de réentrée des PVC ( Figure 1 ).
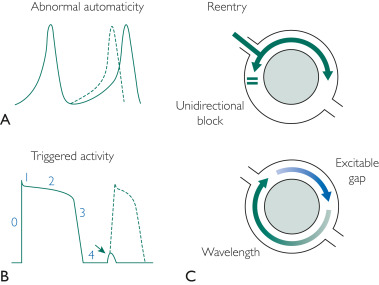
FIGURE 1 . Trois mécanismes d’arythmogenèse prématurée du complexe ventriculaire. A, automaticité anormale : notez l’apparition précoce du potentiel d’action (ligne pointillée). B, Activité déclenchée : notez le retard de l’après-dépolarisation qui se produit dans la phase 4 du potentiel d’action cardiaque. Si celui-ci atteint le seuil, une dépolarisation complète peut se produire (ligne pointillée). Ceci n’est qu’un exemple du mécanisme d’activité déclenchée. C, Réentrée : barrière de conduction (cercle gris, représentant la fibrose ou barrière fonctionnelle) avec bloc unidirectionnel qui produit une arythmie de réentrée.
| Synchronisation électrique et changements hémodynamiques associés |
Un PVC perturbe le remplissage normal des ventricules. En plus du complexe QRS (représentant la contraction ventriculaire) survenant plus tôt que prévu, les PVC ont généralement un aspect QRS plus large (durée plus longue) sur l’ECG par rapport à un complexe QRS typique observé en rythme sinusal ( Figure 2 ).
Les complexes ventriculaires prématurés proviennent d’impulsions électriques focales provenant de différents sites des ventricules. Contrairement à un rythme normal, la conduction électrique avec un CVP n’utilise généralement pas le système de conduction spécialisé.
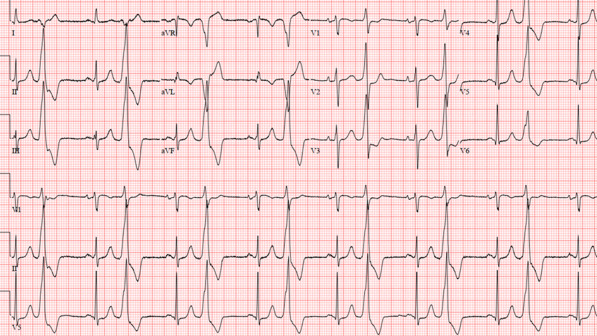
FIGURE 2. Complexes ventriculaires prématurés à configuration bigéminale. Notez les battements larges et complexes qui se produisent tous les deux battements sinusaux (QRS étroit, précédé de l’onde p). Ces contractions ventriculaires prématurées ont un axe inférieur proéminent (positif II, III et aVF et négatif aVR et aVL), ce qui signifie probablement une origine dans la voie d’éjection.
Le remplissage diastolique du ventricule étant perturbé, cela entraîne une réduction du remplissage ventriculaire. Ainsi, le débit cardiaque résultant de la contraction ventriculaire liée au PVC diminue. Les patients peuvent ressentir une multitude de symptômes, notamment un essoufflement, des étourdissements et de la fatigue. De plus, les pressions auriculaires gauches peuvent être considérablement élevées, provoquant une dyspnée due à des pressions pulmonaires plus élevées.
| Évaluation clinique et histoire naturelle de la CVP |
La présentation clinique des PVC peut être variée. La majorité, en particulier ceux dont la charge est faible, sont asymptomatiques chez jusqu’à 50 à 75 % des patients. Pour ceux chez qui des symptômes apparaissent, les manifestations les plus courantes comprennent des extrasystoles, des palpitations et des battements de cœur proéminents avec une sensation de battement.
Dans le cas d’ESV plus fréquentes et hémodynamiquement significatives, les patients peuvent se plaindre de fatigue, de vertiges, de présyncope et de symptômes d’insuffisance cardiaque, tels que dyspnée, orthopnée et œdème.
À l’extrême, les patients présentant des ESV électrophysiologiquement significatives peuvent présenter une syncope et un arrêt cardiaque soudain.
Dans ce contexte, une anamnèse clinique minutieuse doit être obtenue pour différencier les causes de syncope. La syncope vasovagale (réflexe), qui laisse présager une évolution clinique plus bénigne, se présente généralement avec un facteur ou un événement déclenchant (par exemple, déshydratation) et des symptômes précédents (par exemple, nausées, transpiration). La syncope cardiogénique ou arythmogène apparaît soudainement et sans avertissement et peut être associée à l’effort.
Les antécédents familiaux doivent inclure le dépistage de l’insuffisance cardiaque, de la maladie coronarienne, des arythmies, des antécédents de cardiomyopathie et des décès soudains et inexpliqués, en particulier chez les jeunes membres de la famille. Les antécédents sociaux doivent inclure une description détaillée de la consommation de caféine, de la consommation d’alcool, des suppléments, de la consommation de drogues et des facteurs de stress psychologique. Des activités telles que l’exercice et la participation sportive doivent également être évaluées.
Les médicaments qui peuvent déclencher la PVC comprennent les bêta-agonistes (tels que les inhalateurs d’albutérol pour l’asthme ou la maladie pulmonaire obstructive chronique), l’alcool, la caféine et les stimulants tels que ceux dérivés des amphétamines. L’auscultation cardiaque est indispensable. Les signes cliniques d’insuffisance cardiaque doivent être évalués et évalués.
Les antécédents médicaux du patient, la morphologie de l’ESV (qui permet de localiser son origine dans le cœur), les intervalles de couplage de l’ESV (la durée entre la fin du QRS précédent et le début de l’ESV) et la charge tensionnelle sont surveillés. CVP pendant 24 heures est essentiel pour déterminer une prise en charge appropriée.
Certains patients peuvent avoir une faible charge de CVP mais avoir des conséquences graves (telles qu’une mort cardiaque subite) si l’intervalle de couplage est inférieur à 300 millisecondes. Par conséquent, il doit toujours y avoir un niveau élevé de surveillance pour garantir une évaluation appropriée ( Figure 3 ).
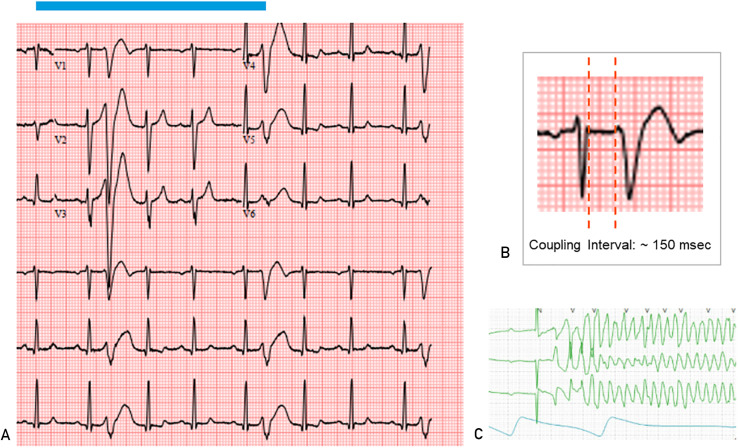
FIGURE 3 . A, électrocardiogramme montrant un complexe ventriculaire prématuré (CVP) à couplage court. Notez que ces PVC à couplage court tombent sur l’onde T du battement sinusal précédent. B, la mesure de l’intervalle de couplage du PVC doit être prise à la fin du QRS antérieur et au début du PVC. C, Bande de télémétrie montrant une tachycardie ventriculaire polymorphe déclenchée par une PVC étroitement couplée chez le même patient.
Plus précisément, l’interniste doit se concentrer sur les caractéristiques suivantes pour orienter vers un cardiologue : symptômes d’ESV, suspicion de syncope cardiaque, antécédents familiaux de mort subite, charge d’ESV supérieure à 10 % et ESV de couplage court (intervalle de couplage < 300 millisecondes). ).
| Stratégie de tests de diagnostic sur mesure pour CVP |
Dans le contexte des soins primaires, l’étendue des tests diagnostiques doit être soigneusement adaptée à la suspicion clinique une fois les antécédents médicaux recueillis et l’examen physique effectué. Chez presque tous les patients sains et asymptomatiques sans maladie cardiaque connue ou suspectée, l’ECG initial est raisonnable. Si des symptômes sont présents ou si l’examen ou l’électrocardiogramme révèle une préoccupation concernant une augmentation de la charge CVP (> 1 battement sur 10), une surveillance Holter doit être effectuée pour une évaluation de 24 heures.
> Électrocardiographie et surveillance Holter
Lors de la surveillance ECG et Holter, le clinicien doit prendre en compte les éléments suivants : la charge de PVC (généralement présentée sous forme de pourcentage sur une période de temps) ; Morphologie et axe du PVC pour aider à localiser le site d’origine ; Intervalle de couplage CVP ; et surtout, si le patient présente des symptômes, corrélation des ESV au moment précis des symptômes.
> Echocardiographie transthoracique
L’échocardiographie transthoracique doit être envisagée chez les patients présentant une charge de PVC supérieure à 5 % ou si les antécédents et l’examen physique l’indiquent cliniquement. En particulier, les cliniciens doivent rechercher une fonction systolique ventriculaire gauche réduite (fraction d’éjection ventriculaire gauche < 50 %) ou des signes d’hypertrophie et de dysfonctionnement ventriculaires gauche ou droit, surtout s’ils sont plus importants que légers.
Une maladie valvulaire , telle qu’un prolapsus de la valvule mitrale ou une disjonction de l’anneau mitral, doit également être envisagée. Les anomalies structurelles cardiaques peuvent laisser présager un risque arythmique ou cardiomyopathique supplémentaire pour les ESV provenant de cette région et doivent donc être orientées vers un cardiologue si elles sont présentes.
> Essais complémentaires
Des tests supplémentaires doivent être guidés par les antécédents et les suspicions cliniques après l’obtention de l’étude. Les études de laboratoire doivent, au minimum, inclure l’évaluation des valeurs des électrolytes sériques , en particulier du potassium et du magnésium. En général, la concentration sérique de potassium doit être maintenue au-dessus de 4,0 mEq/L et la concentration sérique de magnésium doit être maintenue au-dessus de 2,0 mEq/L.
L’hormone stimulant la thyroïde doit être surveillée pour exclure une maladie thyroïdienne comme cause secondaire de PVC.
Le peptide natriurétique cérébral peut être testé comme marqueur sérologique possible d’une anomalie structurelle cardiaque.
Des tests d’effort , avec ou sans imagerie cardiaque supplémentaire (telle qu’une échocardiographie d’effort ou un test d’effort de perfusion nucléaire), peuvent être envisagés pour exclure une cardiopathie ischémique si cela est cliniquement indiqué.
L’imagerie cardiaque avancée, telle que l’IRM cardiaque pour évaluer diverses cardiomyopathies et la tomographie cardiaque par émission de positons pour évaluer une inflammation active, telle que la sarcoïdose cardiaque, doit généralement être réalisée sous la direction de spécialistes en cardiologie. Ces tests ne sont généralement pas effectués systématiquement sans référence en cardiologie.
| Thérapies pour le CVP |
La plupart des patients atteints d’ESV, en particulier ceux présentant un faible fardeau, sont asymptomatiques et ne nécessitent pas d’études, de traitement ou de suivi supplémentaires.
Le médecin de soins primaires doit être à l’aise avec les principes de base de la prise en charge de l’ESV, notamment quand commencer le traitement, les tests de suivi appropriés et quand orienter vers une consultation en cardiologie.
> Conseil et prise en charge non pharmacologique
Il est important de demander aux patients à quel point leurs symptômes sont gênants et si, après avoir été rassurés, ils souhaiteraient même essayer une thérapie médicale ou par ablation par cathéter, étant donné les risques potentiels et les effets indésirables d’une maladie par ailleurs bénigne. De plus, bien qu’il n’existe aucune étude définitive reliant les PVC à ces habitudes de vie, modérer la consommation de caféine et d’alcool, ainsi que cesser de fumer, constituent des conseils raisonnables.
En général, les auteurs recommandent à tous les patients de faire de l’exercice au moins 30 minutes par jour, 5 jours par semaine. Les patients s’en inquiètent souvent et doivent être rassurés sur le fait que l’exercice est sans danger. S’ils présentent une nette aggravation des symptômes avec l’exercice, des études supplémentaires, telles que des tests d’effort, doivent être envisagées.
> Thérapie médicale
Les piliers du traitement pharmacologique sont les bêtabloquants et les inhibiteurs calciques non dihydropyridine (diltiazem ou vérapamil). Il convient de noter que certains patients ne peuvent pas tolérer ces médicaments en raison d’effets indésirables tels que la fatigue, la dépression et la dysfonction érectile. Chez ces patients, s’il existe une fréquence élevée de PVC, des symptômes en corrélation avec une PVC, une insuffisance cardiaque induite par une PVC ou des arythmies, une orientation précoce vers un électrophysiologiste cardiaque doit être recherchée pour envisager une ablation par cathéter.
Les bêtabloquants et les inhibiteurs calciques non dihydropyridines sont des traitements pharmacologiques de première intention. Les deux médicaments ont été associés à des réductions cliniquement significatives de la charge de PVC chez environ 12 à 24 % des patients dans des essais contrôlés randomisés, ce qui indique l’efficacité quelque peu limitée du traitement médicamenteux.
Si les bêtabloquants et les inhibiteurs calciques sont inefficaces, d’autres antiarythmiques peuvent être envisagés si le patient hésite à procéder à une ablation par cathéter. Le sotalol (antiarythmique de classe III), le flécaïnide ( antiarythmique de classe Ic) et la propafénone (antiarythmique de classe Ic) peuvent être bien tolérés et efficaces. L’amiodarone est un médicament très efficace, mais il peut potentiellement provoquer des effets indésirables à long terme qui limitent son utilisation chez les patients plus jeunes.
> Ablation par cathéter
L’ablation par cathéter est une méthode invasive mais efficace de traitement des ESV, avec des taux de réussite procédurale de 80 % à 95 %. Dans les déclarations consensuelles d’experts les plus récentes, les médicaments et l’ablation par cathéter peuvent être considérés comme des traitements de première intention. Par conséquent, la décision d’effectuer directement une procédure d’ablation par cathéter peut être discutée avec les patients qui hésitent à prendre des médicaments à long terme ou qui n’ont pas répondu auparavant aux médicaments en raison d’effets indésirables et d’intolérance.
| Directions futures |
On peut s’attendre à une amélioration de la détection du PVC à l’aide de dispositifs portables dans un avenir proche.
Actuellement, une règle générale est que le clinicien doit toujours examiner manuellement les bandelettes de rythme pour détecter les arythmies détectées par l’appareil afin d’éviter un surdiagnostic des artefacts qui accompagnent fréquemment la pléthysmographie.
La technologie doit toujours rester un complément, et non un substitut, au jugement clinique.
| Conclusion |
À mesure que de plus en plus de patients atteints d’ESV sont identifiés, il est essentiel que le médecin traitant se familiarise avec les principes fondamentaux du diagnostic et du traitement. Les PVC sont extrêmement courants dans la population générale et la plupart ne nécessitent pas d’études ou de traitements supplémentaires, dont la reconnaissance évite des tests supplémentaires inutiles.
Les cliniciens doivent également être attentifs aux ESV symptomatiques ou aux caractéristiques à haut risque, notamment une charge d’ESV supérieure à 10 %, des antécédents familiaux de mort subite, une syncope cardiogénique, des ESV à couplage court (intervalle de couplage < 300 millisecondes) et des signes et symptômes de troubles cardiaques. échec.
Un traitement pharmacologique avec des bêtabloquants ou des inhibiteurs calciques peut être tenté, et une référence à un cardiologue ou à un électrophysiologiste cardiaque est justifiée pour initier un traitement avec des médicaments antiarythmiques ou une ablation par cathéter.
















